Calcogênios
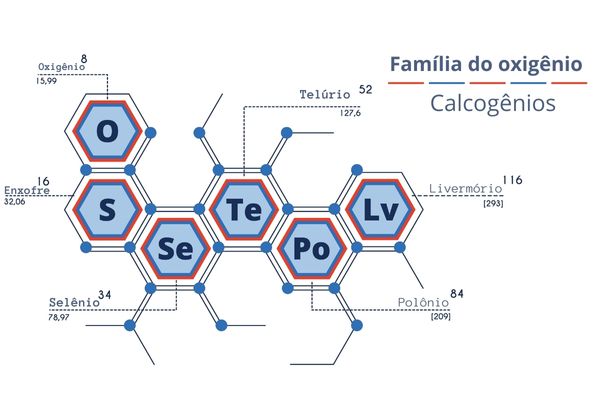
Calcogênios é a denominação dada aos elementos do grupo 16 da Tabela Periódica, também conhecido como família do oxigênio. Esse grupo é formado por oxigênio, enxofre, selênio, telúrio, polônio e livermório.
Os calcogênios são elementos representativos, pertencentes ao bloco p, e possuem configuração eletrônica da camada de valência ns2np4, com seis elétrons na última camada. Uma característica importante do calcogênios é a redução do caráter ametálico de cima para baixo no grupo, sendo apenas os elementos polônio e livermório considerados metálicos.
Leia também: Propriedades periódicas e aperiódicas — as variações possíveis das propriedades dos elementos químicos
Resumo sobre calcogênios
- Calcogênios são os elementos do grupo 16 da Tabela Periódica.
- Esse grupo também é conhecido como família do oxigênio.
- Os elementos químicos calcogênios são o oxigênio, enxofre, selênio, telúrio, polônio e livermório.
- Todos os calcogênios têm seis elétrons de valência e configuração eletrônica ns2np4.
- São elementos representativos, pertencentes ao bloco p.
- O caráter ametálico diminui com o aumento do número atômico.
- Entre os calcogênios, apenas o polônio e o livermorio são metálicos.
- As aplicações desses elementos são variadas, e vão desde o funcionamento de organismos vivos a processos industriais e eletrônicos.
- Enquanto os calcogênios são os elementos químicos do grupo 16, os halogênios são os elementos químicos do grupo 17. Estes possuem configurações eletrônicas e propriedades distintas daqueles.
O que são os calcogênios?
Calcogênios é uma forma de se referir aos elementos químicos do grupo 16 da Tabela Periódica, também conhecido como família do oxigênio.
Esse termo deriva das palavras gregas khalkos e genos, que significam, respectivamente, “cobre” e “origem”, atribuindo-se o significado de “formadores de cobre”, pois o cobre é extraído de minérios formados por esses elementos.
Quais são os calcogênios?
Os elementos químicos do grupo 16, ou calcogênios, são:
- oxigênio (O), Z=8;
- enxofre (S), Z=16;
- selênio (Se), Z=34;
- telúrio (Te), Z=52;
- polônio (Po), Z=84;
- livermório (Lv), Z=116.
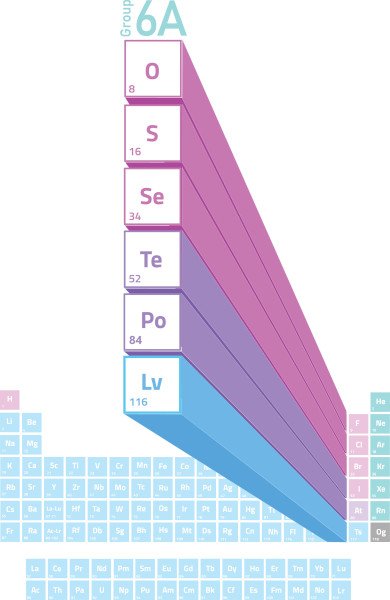
Quais são as características dos calcogênios?
Como os calcogênios constituem um mesmo grupo ou família da Tabela Periódica, seus elementos possuem algumas características em comum, sendo os elementos enxofre, selênio e telúrio os mais semelhantes entre si.
Todos os calcogênios têm seis elétrons na camada de valência, possuindo distribuição eletrônica externa ns2np4. Esses elementos pertencem ao bloco p da Tabela Periódica e são elementos representativos.
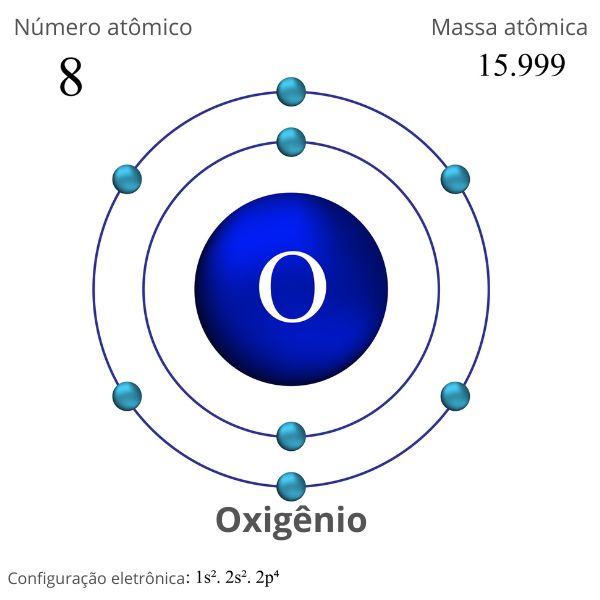
Note a distribuição dos elétrons na camada de valência para o átomo de oxigênio:
O estado de oxidação dominante é -2, podendo apresentar valores +2, +4 e +6, a depender do composto formado. Os calcogênios formam ligações químicas com metais, com o hidrogênio, com os halogênios e entre si mesmos.
Uma característica importante desse grupo é a alteração do caráter metálico, que aumenta de cima para baixo. Os elementos oxigênio, enxofre, selênio e telúrio são ametais. Os elementos polônio e livermório são metais.
Além disso, de modo geral, a eletronegatividade e a energia de ionização diminuem de cima para baixo, no grupo.
O oxigênio possui características bem particulares e diferentes dos demais calcogênios, como pequeno raio iônico, alta eletronegatividade e elevada energia de ionização.
O enxofre ocorre na natureza em sua forma elementar e combinado a outros elementos, fazendo parte da composição do petróleo, do carvão mineral, do gás natural e de sulfatos minerais.
O selênio e o telúrio manifestam propriedades semicondutoras, além de serem capazes de converter a luz em energia elétrica. O telúrio é considerado um elemento raro na natureza.
O polônio é um elemento metálico e radioativo, descoberto por Pierre Currie e Marie Currie em 1898, que foi batizado em homenagem ao país natal de Marie, a Polônia.
O livermório é um elemento artificial e que apenas foi adicionado à Tabela Periódica em 2012, sendo descoberto em meados dos anos 2000, com o uso de um acelerador de partículas. Possui caráter metálico e é radioativo.
Veja também: Quais são os elementos químicos radioativos?
Distribuição eletrônica dos calcogênios
Os calcogênios possuem distribuição eletrônica da camada de valência igual a ns2np4, mantendo 6 elétrons na camada mais externa.
- oxigênio, Z=8, [He] 2s2 2p4;
- enxofre, Z=16, [Ne] 3s2 3p4;
- selênio, Z=34, [Ar] 3d10 4s2 4p4;
- telúrio, Z=52, [Kr] 4d10 5s2 5p4;
- polônio, Z=84, [Xe] 4f14 5d10 6s2 6p4;
- livermório, Z=116, [Rn] 5f14 6d10 7s2 7p4.
Aplicação dos calcogênios
→ Oxigênio

O oxigênio é um dos elementos mais abundantes do planeta Terra, e possui inúmeras aplicações em razão de formar imensa quantidade de compostos químicos, desde moléculas simples, como o gás oxigênio (O2) e o ozônio (O3), a moléculas compostas, como o dióxido de carbono (CO2) e a glicose (C6H12O6).
O O2 compõe 21% da atmosfera e é essencial à sobrevivência humana. Possui aplicações médicas, participa da produção do aço e de diversos processos químicos/industriais. O O3 compõe a camada de ozônio, essencial para a manutenção da temperatura na superfície terrestre. A glicose é um dos principais combustíveis dos organismos vivos.
→ Enxofre

O enxofre é empregado em muitos processos industriais, compondo o ácido sulfúrico (H2SO4), que é um dos produtos químicos mais usados do mundo. O enxofre faz parte da composição de aminoácidos, fertilizantes, inseticidas, pólvora e diversos outros reagentes químicos de relevância industrial. Esse elemento participa do processo de refino do petróleo.
→ Selênio

O selênio é um dos elementos essenciais para os seres vivos, de forma que possui papel biológico. Células fotoelétricas e solares normalmente contêm selênio, em razão da sua capacidade semicondutora. Esse elemento é usado em diversos dispositivos eletrônicos, na fabricação de borrachas, vidros, tintas e outros processos químicos industriais.
→ Telúrio

O telúrio é amplamente empregado na composição de ligas metálicas, aumentando sua resistência mecânica e química, e também na fabricação de borrachas, vidros, revestimentos, inseticidas e catalisadores. Faz parte da montagem de dispositivos semicondutores, como painéis solares.
→ Polônio
O polônio, por ser um elemento radioativo, encontra aplicação como fonte de partículas alfa e de nêutrons, as quais possuem usos específicos na indústria, na área médica e no setor espacial. O polônio vem sendo testado para atuar como fonte de calor em sondas espaciais e satélites. Esse elemento também pode estar presente em cigarros e foi um dos componentes usados na construção das bombas atômicas na Segunda Guerra Mundial. O polônio, em razão da sua radioatividade, é altamente tóxico aos seres vivos.

→ Livermório
O livermório ainda não possui aplicações conhecidas em razão de seu reduzido tempo de vida, instabilidade química e dificuldade de isolamento.
Diferenças entre calcogênios e halogênios
Calcogênios é o nome dado ao grupo 16 da Tabela Periódica. Halogênios é o nome dado ao grupo 17 da Tabela Periódica. Enquanto os calcogênios são os oxigênio, enxofre, selênio, telúrio, polônio e livermório, os halogênios incluem os elementos flúor, cloro, bromo, iodo, astato e tenesso.
Como pertencem a grupos diferentes, halogênios e calcogênios têm configurações eletrônicas diferentes e também propriedades distintas. Os halogênios têm sete elétrons de valência, com configuração da última camada em ns2np5. Todos os halogênios são elementos ametálicos, possuindo maior eletronegatividade e afinidade eletrônica do que os calcogênios (comparação válida para elementos no mesmo período).
Exercícios resolvidos sobre calcogênios
Questão 1
(Unicentro) Os calcogênios são todos os elementos químicos localizados na família ou grupo 16, conhecida antigamente como família VIA, que recebem esse nome por causa da origem grega, khaltos, que significa “cobre”, com a junção do termo genos, que quer dizer “origem nobre”. De forma geral, os calcogênios apresentam como principal característica o fato de os elementos naturais, com exceção do livermório, que é artificial, dessa família formarem compostos químicos com o elemento cobre (Cu). A denominação calcogênios (geradores de cobre) é atribuída aos gregos, devido à obtenção de o cobre ser feita a partir de minérios, como Cu2O e Cu2S. Em relação ao grupo dos calcogênios, pode-se afirmar:
A) É formado apenas por não metais.
B) Apresenta elementos químicos com subníveis d incompletos.
C) Contém os elementos químicos de mais baixa energia de ionização.
D) É isento de elementos químicos radioativos.
E) É constituído por elementos representativos.
Resolução:
Alternativa E
Item A incorreto. Entre os calcogênios, oxigênio, enxofre, selênio e telúrio são elementos ametálicos e polônio e livermório são metálicos.
Item B incorreto. Os calcogênios possuem distribuição eletrônica em ns2np4, com subnível p incompleto.
Item C incorreto. A energia de ionização é a energia necessária para remover um elétron do átomo em fase gasosa, e ela é alta em elementos de maior eletronegatividade, pois os elétrons ficam atraídos com mais força. Como os calcogênios estão mais à direita da Tabela Periódica, possuem alta eletronegatividade e alta energia de ionização.
Item D incorreto. O polônio é um elemento radioativo.
Item E correto. Os elementos representativos são aqueles presentes nos blocos s e p da Tabela Periódica. Os calcogênios pertencem ao bloco p.
Questão 2
(Cesmac - adaptada) Os calcogênios são os elementos químicos do grupo 16 da Tabela Periódica. Os três primeiros elementos: oxigênio, enxofre e selênio são de grande importância para os sistemas biológicos. O oxigênio é necessário para quase todos os organismos com a finalidade de gerar ATP. É também um componente-chave presente em água, aminoácidos e DNA. Todos os animais necessitam de quantidades significativas de enxofre (alguns aminoácidos, como cisteína e metionina, contêm enxofre). Em menor intensidade, os animais e algumas plantas necessitam de vestígios de selênio, mas apenas para algumas enzimas especializadas. De acordo com a Tabela Periódica (família dos calcogênios), assinale a alternativa correta.
A) Dentre os calcogênios, o polônio apresenta maior eletronegatividade.
B) Dentre os calcogênios, o oxigênio apresenta o menor raio atômico.
C) Além de O, S e Se, também fazem parte da família dos calcogênios: Te e Po.
D) O oxigênio apresenta distribuição eletrônica: 1s2 2s2 2p6.
E) Todos os elementos da família dos calcogênios são considerados metais.
Resolução:
Alternativa B
Item A incorreto, pois a eletronegatividade cresce de baixo para cima em um grupo. Portanto, o oxigênio é o mais eletronegativo entre os calcogênios.
Item B correto. O raio atômico é uma propriedade periódica que cresce de cima para baixo em um grupo, conforme se aumenta as camadas eletrônicas. Como o oxigênio é o primeiro elemento desse grupo, ele possui o menor raio atômico.
Item C incorreto. Compõem a família dos calcogênios o oxigênio, enxofre, selênio, telúrio, polônio e livermório.
Item D incorreto. Os calcogênios possuem distribuição eletrônica da camada de valência em ns2np4.
Item E incorreto. Apenas o polônio e o livermório são metais.
Artigos Relacionados

Últimas notícias
Outras matérias


















