Cálculo do pH de uma solução-tampão
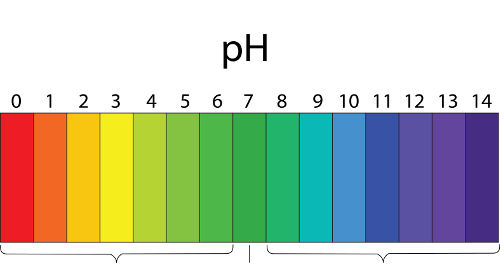
Os cientistas Henderson e Hasselbalch desenvolveram uma expressão matemática para realizar o cálculo do pH de uma solução-tampão, a qual leva em consideração o pKa e a concentração de um ácido fraco [ácido] e a concentração do sal [sal]:
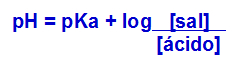
Fórmula para cálculo do pH de uma solução-tampão
Obs.: pKa é igual ao colog da constante de ionização do ácido (Ka). Logo, seu valor pode ser determinado por –log [Ka].
Como observado acima, Henderson e Hasselbalch criaram a fórmula para o cálculo do pH de uma solução-tampão, formada por um ácido fraco e um sal que apresenta o mesmo ânion desse ácido. Porém, é importante lembrar que uma solução-tampão pode ser formada também por uma base fraca e um sal que possua o mesmo cátion da base.
Para realizar o cálculo do pH de uma solução-tampão, formada por uma base fraca e por um sal com mesmo cátion, inicialmente, devemos determinar o seu pOH pela expressão a seguir, a qual leva em consideração o mesmo raciocínio da expressão de Henderson e Hasselbalch:
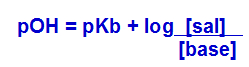
Fórmula para cálculo do pH de uma solução-tampão
Obs.: pKb é igual ao colog da constante de dissociação da base (Kb). Assim, seu valor pode ser determinado por –log [Kb].
Nessa expressão, a diferença com relação à expressão de Hasselbalch é que utilizamos o valor do pKb e a concentração da base [base]. Porém, para chegar ao valor do pH da solução-tampão, formada por uma base fraca e um sal, devemos utilizar a seguinte expressão (para soluções à 25 oC):
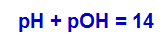
Fórmula para cálculo do pH e pOH de uma solução-tampão
Outra forma de calcular o pH de uma solução-tampão é utilizando uma expressão matemática que relaciona o pH com o pKw e o pKb, como podemos observar abaixo:
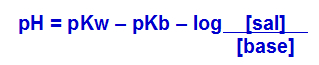
Fórmula alternativa para cálculo do pH de uma solução-tampão
Acompanhe a seguir alguns exemplos de cálculo do pH de uma solução-tampão:
1º Exemplo - (UEM-PR) Qual é o pH aproximado de uma solução obtida através da mistura de 100 mL de uma solução aquosa de HCN 1.10–2 mol. L–1 com 100 mL de uma solução aquosa de KCN 5.10–2 mol.L–1, sabendo-se que o Ka do HCN é 4,9 x 10–10 (pKa = 9,31)?
(Dados: log 5 = 0,7).
a) pH = 2
b) pH = 12
c) pH = 10
d) pH = 7
e) pH = 4
Os dados fornecidos pelo exercício foram:
-
[ácido] = 1.10–2
-
[sal] = 5.10–2
-
pKa = 9,31
-
log 5 = 0,7
-
pH = ?
Para realizar o cálculo do pH dessa solução-tampão, basta utilizar os valores na expressão de Henderson e Hasselbalch:
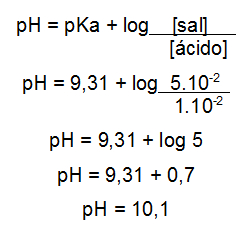
Cálculo do pH de uma solução-tampão
2º Exemplo: (PUC-SP) O ácido acético, CH3COOH, possui uma constante de dissociação, (Ka), igual a 1,8.10–5. Relativamente às soluções aquosas de ácido acético, pedem-se:
a) O valor de pH de uma solução 0,1 mol/L de CH3COOH;
Para determinar o pH da solução de CH3COOH, a partir da sua concentração molar, basta utilizar a expressão que aplica o cologaritmo da concentração do hidrônio (que é igual a concentração molar do ácido, já que o exercício não informa seu grau de ionização, α):
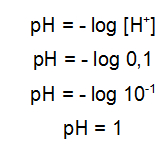
Cálculo do pH de uma solução ácida
b) A relação entre as concentrações de CH3COOH e de CH3COONa que deve ser usada para preparar uma solução-tampão de pH = 5. Dado log 1,34 = 0,13
Dados fornecidos pelo exercício:
-
log 1,34 = 0,13
-
Ka = 1,8.10–5
-
pH = 5
-
CH3COOH = x
CH3COONa
Obs.: Nesse exemplo, vamos utilizar a fórmula para o cálculo do pH de uma solução-tampão para calcular outro aspecto com relação à solução.
Para determinar o valor da relação pedida pelo exercício, devemos utilizar a expressão de Hasselbalch, já que se trata de um tampão formado por um ácido fraco e um sal:

Utilização da expressão para o cálculo do pH solicitado no exercício
Obs.: Quando temos a subtração de logaritmos, podemos utilizar a propriedade logarítmica, na qual há a divisão entre esses dois logaritmos.
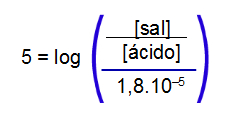
Agrupando os dois logaritmos da expressão
Obs.: Para eliminar o logaritmo, basta utilizar a propriedade logarítmica, na qual a base 10 do logaritmo deve ter o valor do outro lado da igualdade como expoente.
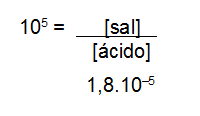
Excluindo o logaritmo da expressão
Assim, ao multiplicar cruzado, temos:
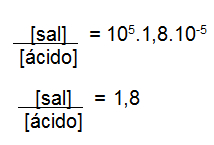
Resultado da relação entre a concentração do sal pelo ácido
Como o exercício pede a relação entre a concentração do ácido pela concentração do sal:
Artigos Relacionados

Últimas notícias
Outras matérias



















