Cálculos envolvendo a tonoscopia
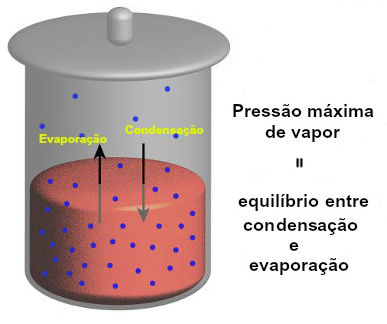
Os cálculos envolvendo a tonoscopia são determinações matemáticas sobre a variação da pressão máxima de vapor de uma solução, as quais se baseiam em duas leis: a lei de Raoult e a lei de Babo:
-
Lei de Raoult: De acordo com Raoult, o abaixamento relativo da pressão máxima de vapor é diretamente proporcional à fração molar do soluto (X1).
Δp = X1
p2
Expressão qual :
Δp = abaixamento absoluto da pressão máxima de vapor
X1 = fração molar do soluto
p2 = pressão máxima de vapor do solvente
-
Lei de Babo: O abaixamento relativo da pressão máxima de vapor não varia com a temperatura, apenas as pressões de vapor da solução e do solvente sofrem variação com a temperatura.
Além da fórmula apresentada acima, outras fórmulas podem ser utilizadas nos cálculos envolvendo a tonoscopia, como:
a) Cálculo do abaixamento absoluto (Δp)
Δp = p2 - p
Nessa expressão temos a subtração da pressão de vapor do solvente pela pressão de vapor da solução.
Δp = abaixamento absoluto da pressão máxima de vapor
p2 = pressão máxima de vapor do solvente
p = pressão máxima de vapor do solvente na solução
b) Relação entre o abaixamento relativo e a molalidade
O abaixamento relativo da pressão máxima de vapor pode ser calculado utilizando-se o valor da molalidade (W), porém, neste caso a molalidade sempre está relacionada diretamente à constante tonoscópica (Kt) do solvente.
Δp = kt.W
p2
Expressão qual :
Δp = abaixamento relativo da pressão máxima de vapor
p2 = pressão máxima de vapor do solvente
kt = constante tonoscópica
W = molalidade
Caso o exercício não forneça a molalidade, podemos calculá-la na expressão abaixo:
W = m1
M1.m2
Obs.: A massa do solvente na molalidade é sempre trabalhada na unidade quilograma (Kg).
Assim, podemos substituir a fórmula da molalidade na fórmula do abaixamento relativo, resultando em:
Δp = Kt.m1
p2 M1.m2
Exemplo 1- (IME RJ) Determine o abaixamento relativo da pressão de vapor do solvente quando 3,04 g de cânfora (C10H16O) são dissolvidos em 117,2 mL de etanol (C10H16O) a 25oC. (Dados: densidade do etanol = 0,78g/mL).
Os dados fornecidos pelo exercício foram:
Massa do soluto = 3,04g
Volume do solvente (etanol) = 117,2 mL
Abaixamento relativo (Δp) = ?
p2
Para calcular o abaixamento relativo precisamos da massa do soluto, da constante tonoscópica, massa do solvente e a massa molar do soluto. Abaixo, temos os passos para encontrar os dados que não foram fornecidos pelo exercício:
1o Passo: Calcular a massa do solvente (etanol) através da fórmula da densidade:
d(etanol) = metanol
Vetanol
0,78 = metanol
117,2
metanol = 117,2.0,78
metanol = 91,416g, porém, no cálculo tonoscópico a massa do solvente deve ser trabalhada em Kg, assim temos 0,0091416 Kg etanol.
2o Passo: calcular a massa molar do soluto (C10H16O) através da soma dos resultados das multiplicações do número de átomos do elemento pela sua massa molar:
M1 = 10.12 + 16.1 + 1.16
M1 = 120 + 16 + 16
M1 = 152 g/mol
3o Passo: calcular a massa molar do solvente (C2H6O) através da soma dos resultados das multiplicações do número de átomos do elemento pela sua massa molar:
M2 = 2.12 + 6.1 + 1.16
M2 = 24 + 6 + 16
M2 = 46 g/mol
4o Passo: calcular a constante tonoscópica do solvente, dividindo sua massa molar por 1000
kt = M2
1000
kt = 46
1000
kt = 0,046
5o Passo: calcular o abaixamento relativo na expressão abaixo
Δp = Kt.m1
p2 M1.m2
Δp = 0,046.3,04
p2 152. 0,091416
Δp = 0,13984
p2 13,8952
Δp = 0,01
p
Exemplo 2- (ACAFE-SC) O abaixamento da pressão de vapor do solvente em soluções não eletrolíticas pode ser estudado pela Lei de Raoult: P1 = X1.P1, onde P1 é a pressão de vapor do solvente na solução, P1º é a pressão de vapor do solvente puro à mesma temperatura e X1 é a fração molar do solvente. Qual a variação da pressão de vapor do solvente (em módulo) de uma solução que possui 18g de glicose em 90g da água a 40ºC? Dados: Considere que a pressão de vapor da água a 40ºC = 55,3 mmHg; massa molar da glicose = 180 g/mol; massa molar da água = 18 g/mol).
a) 3,4 mmHg
b) 54,2 mmHg
c) 2,4 mmHg
d) 1,1 mmHg
Dados fornecidos pelo exercício:
-
massa soluto = 18g de glicose
-
massa do solvente = 90g da água
-
Pressão de vapor da água a 40ºC = 55,3 mmHg;
-
Massa molar da glicose (M1) = 180 g/mol;
-
Massa molar da água (M2) = 18 g/mol)
Para calcular a variação da pressão de vapor são necessárias: a massa do soluto, a constante tonoscópica, a massa molar do soluto e a massa do solvente. Abaixo, temos os passos para encontrar os dados que não foram fornecidos pelo exercício:
1o Passo: calcular a constante tonoscópica do solvente, dividindo sua massa molar por 1000
kt = M2
1000
kt = 18
1000
kt = 0,018
2o Passo: calcular o abaixamento relativo na expressão abaixo
Δp = Kt.m1
p2 M1.m2
Δp = 0,018.18
55,3 180. 0,09
16,2. Δp = 55,3.0,324
Δp = 17,9172
16,2
Δp = 1,106 mmHg
Artigos Relacionados

Últimas notícias
Outras matérias


















