Cloro (Cl)

O cloro (Cl) pertence ao grupo 17 da Tabela Periódica, conhecido como família dos halogênios. Em temperatura ambiente, é um gás (Cl2) de coloração amarelo-esverdeada, odor característico e altamente irritante ao trato respiratório e aos tecidos oculares. A inalação de Cl2 em alta concentração pode levar à morte.
É um elemento bastante eletronegativo, possuindo alta tendência em formar compostos químicos, tanto com elementos metálicos como não metálicos. Por essa razão, não é encontrado em sua forma pura na natureza, mas ocorre associado a outros elementos químicos, sendo o cloreto de sódio o composto mais comum. Os sais de cloreto são abundantes no mineral sal-gema e em águas salgadas.
O cloro é uma substância de grande importância industrial e econômica. Sua principal forma de obtenção é por meio do processo cloro-álcali, em que ocorre a eletrólise aquosa do cloreto de sódio. Compostos de cloro e o próprio gás cloro são fortes agentes oxidantes e fazem parte de produtos de limpeza, por causa da sua ação desinfetante.
Leia também: Adição de “cloro” na piscina — será mesmo ele o causador daquele cheiro característico?
Resumo sobre o cloro
-
O cloro (Cl) é um halogênio, pertence ao grupo 17 da Tabela Periódica e tem número atômico 17.
-
O gás cloro (Cl2) possui coloração amarelo-esverdeada e odor característico. É um gás sufocante que causa irritação ao trato respiratório e tecido ocular.
-
O cloro é bastante eletronegativo e possui forte tendência em formar compostos químicos com outros elementos.
-
Na natureza, o cloro pode ser encontrado no mineral sal-gema e em águas salgadas, principalmente sob a forma de cloreto de sódio (NaCl).
-
O gás cloro e alguns de seus compostos são fortemente oxidantes, possuindo ação desinfetante e branqueadora. Por isso, são a base de muitos produtos de limpeza desinfetantes domésticos e industriais.
-
A eletrólise aquosa do cloreto de sódio é a principal forma de obtenção do cloro.
-
O cloro faz parte do processo de fabricação de diversos produtos, como o PVC, fármacos e solventes químicos.
Propriedades do cloro
-
Símbolo: Cl.
-
Número atômico: 17.
-
Massa atômica: 35,45 u.m.a.
-
Configuração eletrônica: [Ne] 3s2 3p5.
-
Estado físico: gás (a 20 °C).
-
Ponto de fusão: -101,5 °C.
-
Ponto de ebulição: -34,0 °C.
-
Densidade: 0,0029 g/cm3.
-
Eletronegatividade: 3,16 (escala de Pauling).
-
Série química: elementos representativos.
-
Localização na Tabela Periódica: grupo 17, período 3, bloco p.
-
Isótopos: 35Cl (75,76%) e 37Cl (24,24%).
Características do cloro
O cloro é um elemento químico pertencente ao grupo 17 da Tabela Periódica, conhecido como família dos halogênios. Em temperatura ambiente e pressão atmosférica, o cloro é um gás de coloração amarelo-esverdeada que se torna líquido ao ser resfriado até a temperatura de -34 °C.

As moléculas de gás cloro são diatômicas, existindo sob a forma de Cl2. Essa espécie é um gás irritante, possui odor característico e é sufocante. A sua inalação causa asfixia e sensação de pressão na garganta e no peito. Após exposição severa ao gás cloro, pode ocorrer acúmulo de líquido nos pulmões. O gás cloro foi a primeira arma química utilizada em guerras.
O elemento cloro é o quarto mais eletronegativo da Tabela Periódica e possui alta afinidade eletrônica. Essas propriedades o tornam bastante reativo, característica verificada pela grande quantidade de compostos que contém cloro.
Um exemplo da sua elevada reatividade é a reação com o gás hidrogênio, que pode acontecer de forma explosiva pela simples presença de luz (representada por \(h\nu\)), formando como produto ácido clorídrico (HCl):
\(H_2+Cl_2+\buildrel h\nu \over \longrightarrow 2\ HCl\)
A alta afinidade entre o cloro e o hidrogênio faz com que o halogênio reaja com muitos compostos que contêm hidrogênio. No caso dos hidrocarbonetos, o cloro pode substituir um ou mais hidrogênios na cadeia carbônica, em uma reação de halogenação conhecida como cloração:
\({CH}_4+\ {Cl}_2\ \rightarrow\ {CH}_4Cl+HCl\)
Na realidade, o cloro consegue se combinar com muitos elementos da Tabela Periódica para formar os respectivos cloretos, que podem ser compostos iônicos ou moleculares.
-
Ao formar ligações com os metais, o composto obtido possui caráter iônico. Veja o exemplo de formação do sal iônico NaCl:
\(Na\ \left(s\right)+\ {Cl}_2\ \left(g\right)\rightarrow2\ NaCl\ \left(s\right)\)
-
Ao se combinar com elementos não metálicos, os compostos são majoritariamente moleculares. Veja o exemplo de formação do ácido clorídrico (composto molecular) por meio da reação entre gás cloro e gás hidrogênio:
\(H_2+\ {Cl}_2\ \rightarrow\ 2\ HCl\)
Em água, o cloro é moderadamente solúvel e forma a “água clorada”, solução aquosa, com HCl e HClO, de caráter ácido e com propriedades oxidantes, em razão da presença do ácido hipocloroso (HClO). A propriedade oxidante desse ácido torna-o uma substância desinfetante amplamente utilizada no tratamento de água, em produtos de limpeza e como agente branqueador na indústria.
\({Cl}_2\left(g\right)+\ H_2O\ \left(l\right)\rightarrow HClO\ \left(aq\right)+\ H_3O^+\ \left(aq\right)+\ {Cl}^-(aq)\)
A propriedade oxidante (e desinfetante) do HClO diminui com o tempo em razão da sua decomposição, por isso é muito útil utilizar os sais derivados dessa substância ― como o hipoclorito de sódio (NaClO) ― para que a propriedade desinfetante seja mantida.
A água sanitária é um produto de limpeza doméstica composto por NaClO (hipoclorito de sódio) e funciona muito bem como agente desinfetante de superfícies e objetos, pois mantém a espécie HClO no meio, como mostrado pelas equações químicas:
\(NaClO\ \left(s\right)\ \rightarrow\ {Na}^+\left(aq\right)+\ {ClO}^-\ \left(aq\right)\)
\({ClO}^-\ \left(aq\right)+\ H_2O\ (l)\rightarrow HClO\ \left(aq\right)+\ {OH}^-(aq)\)
Por isso, soluções de hipoclorito de sódio em concentração de cerca de 2,5% são também conhecidas como “cloro ativo” ou “cloro líquido”.
Na maior parte dos compostos de que faz parte, o cloro mantém estado de oxidação -1. Outros estados de oxidação também podem ocorrer, como +1, +3, +5 e +7.
Os isótopos estáveis do cloro possuem massa atômica 35 e 37, e existem naturalmente em proporção de 3 35Cl para 1 37Cl, fator que determina a massa atômica média do cloro em torno de 35,5 u.m.a. Outros isótopos do cloro são conhecidos, mas são instáveis e possuem tempo de meia-vida bastante reduzidos.
Leia também: 11 ácidos bastante conhecidos por suas aplicações no cotidiano
Onde se encontra o cloro?
O cloro não é encontrado livremente na natureza, pois em razão da sua alta reatividade, se combina rapidamente com outros elementos para formar compostos químicos. Por isso, suas formas de ocorrência mais comuns são como cloretos e cloratos, sendo o cloreto de sódio (NaCl) um de seus principais compostos.
Esse elemento é encontrado principalmente na água do mar e em lagos salgados, ambientes em que pode alcançar concentração de 19 g/kg, e em minas de sal-gema.
O sal-gema, ou sal de rocha, é um mineral rico em cloro, formado pelos compostos cloreto de sódio (NaCl), cloreto de potássio (KCl) e cloreto de magnésio (MgCl2). Outros minerais ricos em cloro são a silvita (KCl) e a carnalita (KMgCl3.6 H2O).

No corpo humano, o cloro está presente nos fluidos corporais sob a forma de íons cloreto (Cl-). Também está presente no suco gástrico sob a forma de ácido clorídrico (HCl), cuja função é reduzir o pH estomacal para promover a digestão dos alimentos.
Como se obtém o cloro?
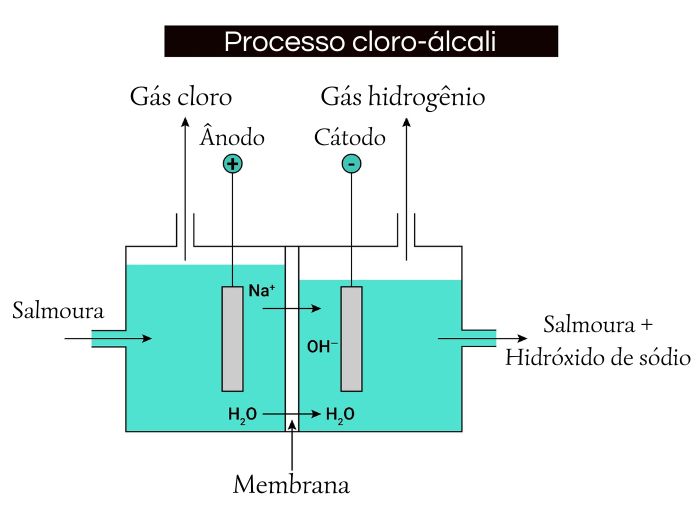
Cerca de 95% de todo o cloro produzido mundialmente é obtido pelo processo conhecido como cloro-álcali. Nesse procedimento, é realizada a eletrólise aquosa do sal cloreto de sódio, solução chamada de salmoura. Além do cloro, é obtido também como produto o hidróxido de sódio (NaOH), substância conhecida como soda cáustica.
O cloro e a soda cáustica estão entre as substâncias químicas mais utilizadas na indústria química mundial, por isso, o processo cloro-álcali é de extrema relevância comercial.
A eletrólise da salmoura pode ser realizada de três formas distintas, utilizando células de mercúrio, de diafragma ou de membrana.
Na eletrólise aquosa do NaCl, gás hidrogênio é gerado no cátodo, gás cloro é produzido no ânodo e, ao mesmo tempo, hidróxido de sódio é formado no próprio eletrólito. Esses processos são descritos pelas equações químicas abaixo:
Reação que ocorre no cátodo:
\(2\ H_2O+\ {2e}^-\ \rightarrow2\ {OH}^-+\ H_2\)
Reação que ocorre no ânodo:
\({2\ Cl}^-\ \rightarrow\ {Cl}_2+\ \ {2e}^-\)
Equação global de eletrólise:
\(2\ H_2O+\ {2\ Cl}^-\ \rightarrow2\ {OH}^-+\ H_2+\ {Cl}_2\)
Note que o NaOH será formado pela combinação entre os íons Na+ presentes na solução e os íons OH- que foram gerados no cátodo.
Durante o procedimento, os íons hidróxido e o gás cloro não podem entrar em contato. Para evitar isso, uma placa porosa fibrosa é inserida entre os eletrodos na célula de diafragma.
Quando se usa a célula de amálgama de mercúrio, o cátodo de ferro é substituído por um cátodo de mercúrio líquido. Nesse caso, não há formação de íons hidróxido, e o sódio é dissolvido no mercúrio, formando um amálgama. Por meio da reação do amálgama com água (em uma etapa posterior), o mercúrio é recuperado e novamente utilizado na eletrólise, e o sódio forma a soda cáustica.
A utilização de células de mercúrio vem sendo descontinuada, em razão da sua elevada toxicidade e da ocorrência de perdas durante o procedimento, mesmo que este dê origem a cloro de maior pureza. As células de diafragma ainda são bastante utilizadas, mas apresentam o ponto negativo de produzir NaOH de menor pureza.
Atualmente, vem sendo incentivado o uso de células eletrolíticas com membrana, que são formadas por material sintético e são seletivas, permitindo a passagem de íons sódio (Na+) e barrando os íons hidróxido (OH-) e cloreto (Cl-). A vantagem é a formação de NaOH de maior pureza.
Outra forma de extração do cloro é pelo sal-gema, por meio do qual o cloro pode ser obtido sob a forma de seus compostos com sódio e potássio. A rocha é solubilizada em água, formando uma solução aquosa com alta concentração de sais. A água é então evaporada, e os sais são purificados para consumo humano, ficando sob a forma de sal grosso.
A obtenção dos sais da água salgada também ocorre por evaporação da água e purificação dos sais de cloreto.
O sal de cozinha ou sal comum é um cloreto de sódio refinado que passou por muitas etapas de purificação e que recebe alguns aditivos, como os iodatos.
Quais são as aplicações do cloro?
O cloro tem relevante papel no setor industrial e é essencial para o tratamento de água para consumo humano.
Uma das etapas do processo de tratamento da água é a cloração, que consiste na adição de gás cloro (Cl2) à água, gerando ácido hipocloroso (HClO) e atuando na regulação do pH. O HClO é um forte oxidante, que elimina agentes causadores de doenças e infecções, como vírus e bactérias.
As propriedades oxidantes e desinfetantes do gás cloro, do ácido hipocloroso e de seus sais (NaClO) são amplamente empregadas em produtos de limpeza domésticos e industriais e na manutenção de piscinas. A função branqueadora do cloro é explorada na produção de papel e de tecidos.
O cloro participa da cadeia de produção do cloreto de vinila, que é matéria-prima para o polímero policloreto de vinila, popularmente conhecido como PVC. Outros polímeros também demandam cloro para sua produção, como o teflon e algumas borrachas sintéticas.
Além disso, o cloro é empregado na síntese de diferentes produtos químicos com aplicações industriais, como o clorofórmio, o tetracloreto de carbono e o ácido clorídrico (HCl). O ácido clorídrico é um reagente de extrema importância na indústria e em laboratórios de pesquisa e pode ser obtido em larga escala pela reação com o gás hidrogênio.
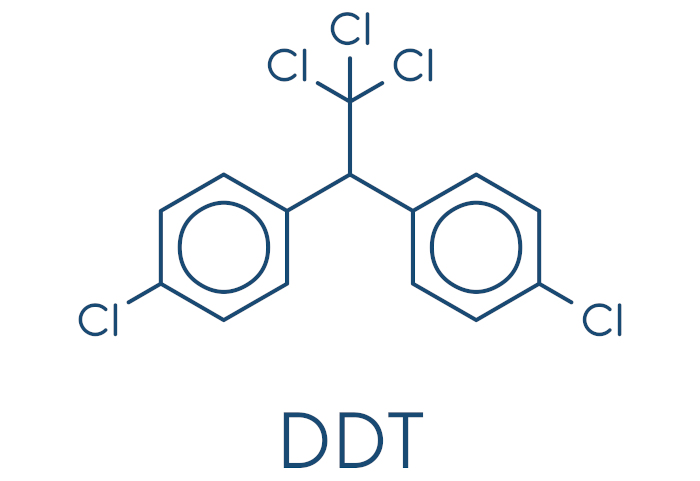
Na agricultura, o cloro teve um papel importante para o controle de pragas e de doenças de lavouras por meio do uso do pesticida diclorodifeniltricloroetano (DDT). Esse composto teve seu uso banido, em razão da alta toxicidade e dificuldade de degradação. Ele é um dos poluentes orgânicos persistentes (POPs), e é possível encontrar seus vestígios por todo o planeta.
No setor farmacêutico, o cloro é um dos componentes básicos de mais de 80% dos fármacos empregados em diversos tipos de tratamentos, como hipertensão, diabetes, alergias, entre outros.
Precauções com o cloro
O cloro é um gás irritante ao sistema respiratório, sendo muito agressivo à mucosa das narinas e ao tecido dos olhos, causando intenso ressecamento. Quando em estado líquido, é responsável por severas queimaduras na pele. Sua presença no ar pode ser detectada por um odor irritante característico.
Sua inalação causa sérios danos aos pulmões. Quando ocorre de forma recorrente, mesmo que em baixa concentração, leva a uma fragilidade dos pulmões.
Em situações mais graves, pode causar morte e edema pulmonar, que é a situação clínica conhecida como líquido nos pulmões. Isso ocorre em razão do ressecamento causado por essa substância, que induz o organismo a bombear líquidos para a região afetada, causando uma espécie de morte por afogamento.
Alguns setores da indústria devem manter uma rotina de controle e medição dos níveis de cloro na atmosfera interna do ambiente industrial.
Leia também: Amianto — material bastante utilizado na indústria, mas extremamente perigoso ao ser humano
O cloro mata as bactérias por quê?
É recomendado a higienização de frutas, verduras e legumes com água sanitária após a compra no mercado ou na feira. Em tempos de coronavírus, também é comum as pessoas limparem as superfícies e os locais recorrentemente com água sanitária. Essas ações visam a desinfetar e limpar os ambientes ou os objetos.
O poder desinfetante do cloro ― e de alguns de seus derivados ― é explicado pela sua forte capacidade oxidante. Isso significa que esse elemento é capaz de oxidar, isto é, de danificar as membranas celulares de bactérias, vírus e protozoários.
A membrana é a camada lipídica que protege as células. Dessa forma, esses organismos são exterminados pela sua simples destruição, pela danificação de suas proteínas constituintes ou ainda pela alteração do funcionamento de algumas enzimas, responsáveis por mecanismos de sobrevivência.
História do cloro
O cloro é um elemento abundante na natureza e ocorre principalmente associado ao sódio no mineral sal-gema, formado por cloreto de sódio. Em razão da abundância natural desse mineral, o cloro já encontrava aplicações desde a Antiguidade.
Por exemplo, o termo “salário” que conhecemos hoje como retribuição pecuniária pelo trabalho deriva da época romana, em que soldados e trabalhadores eram pagos em sal, o mesmo sal que hoje utilizamos em casa, composto por cloreto de sódio.
Há registros que indicam a manipulação de derivados de cloro em laboratórios já no século XVII. O químico alemão Johann Glauber aqueceu sal (NaCl) úmido em fornos de carvão, formando gases ácidos irritantes que mais tarde foram identificados como ácido clorídrico.
No século XVIII, o químico sueco Carl Wilhelm Scheele combinou o mineral pirolusita (óxido de manganês MnO2) com ácido clorídrico e obteve um gás denso, de cor amarelo-esverdeada e com característica sufocante. Hoje, esse gás é conhecido como cloro, mas na época não foi reconhecido como elemento.
O cloro como elemento químico foi identificado apenas em 1810, cerca de 40 anos após os experimentos de Scheele. O responsável pelo reconhecimento foi Humphty Davy, que identificou que o cloro não podia ser decomposto, caracterizando-o então como elemento químico. Davy o batizou inspirado em um termo grego que se refere à coloração verde-amarelada característica dessa substância gasosa.
Durante a Primeira Guerra Mundial, em 1915, o estudioso alemão Fritz Haber utilizou seu conhecimento científico para atacar os oponentes, propondo o uso de gás cloro para expulsar as tropas inimigas das trincheiras e estabelecer um combate a céu aberto. A ideia de Haber foi aceita, e as tropas alemãs lançaram uma grande quantidade de gás cloro sobre a cidade Ypres, na Bélgica. O resultado foi catastrófico, matando aproximadamente cinco mil soldados e ferindo outros dez mil.
Artigos Relacionados

Últimas notícias
Outras matérias


















