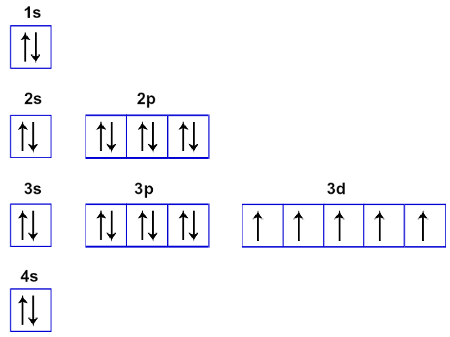
Distribuição eletrônica em orbitais

A distribuição eletrônica em orbitais é uma forma alternativa de apresentar o posicionamento dos elétrons de um átomo, realizada no diagrama de Linus Pauling, dando ênfase aos orbitais aos quais eles pertencem.
Para realizar uma distribuição eletrônica em orbitais, devemos fazer uma distribuição eletrônica convencional e, em seguida, posicionar os elétrons nos orbitais de acordo com o número de orbitais em cada subnível, distribuído conforme a seguir:
-
Subnível s: possui um orbital.

Representação do orbital do subnível s
-
Subnível p: possui três orbitais.
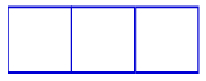
Representação dos orbitais do subnível p
-
Subnível d: possui cinco orbitais.
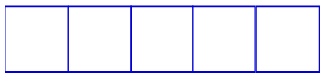
Representação dos orbitais do subnível d
-
Subnível f: possui sete orbitais.
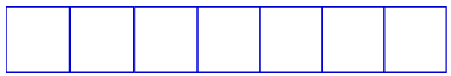
Representação dos orbitais do subnível f
Vale ressaltar que, de acordo com Pauling, cada orbital, independentemente do subnível, pode receber no máximo dois elétrons.
O preenchimento dos orbitais segue a regra de Hund, a qual indica que um orbital de um subnível somente recebe o segundo elétron depois de todos os outros orbitais do subnível terem recebido o primeiro elétron. Exemplo:
.jpg)
Representação dos orbitais do subnível p
O primeiro orbital receberá o segundo elétron apenas se todos os três tiverem recebido o primeiro elétron:
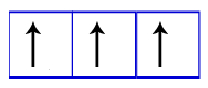
Representação dos orbitais do subnível p com elétrons
Após todos os orbitais do subnível terem recebido um elétron, o orbital recebe o segundo elétron, como no exemplo abaixo:
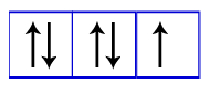
Cinco elétrons nos orbitais do subnível p
Assim, a partir dessas informações, acompanhe agora como deve ser realizada uma distribuição eletrônica em orbitais com o exemplo do elemento químico manganês, cujo número atômico é 25:
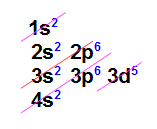
Distribuição eletrônica fundamental do elemento manganês
O manganês possui elétrons distribuídos em quatro níveis. A seguir, temos a representação desses elétrons em cada orbital de cada um dos subníveis desses níveis:
-
Primeiro nível: com dois elétrons no orbital do subnível s
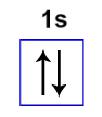
Representação do orbital do subnível s com elétrons
-
Segundo nível: com dois elétrons no orbital do subnível s, e seis elétrons nos três orbitais do subnível p.
.jpg)
Representação dos orbitais dos subníveis s e p com elétrons
-
Terceiro nível: com dois elétrons no orbital do subnível s, seis elétrons nos três orbitais do subnível p, e cinco elétrons nos orbitais do subnível d.
.jpg)
Representação dos orbitais dos subníveis s, p e d com elétrons
-
Quarto nível: com dois elétrons no orbital do subnível s
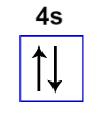
Representação do orbital do subnível s com elétrons
Com isso, a distribuição eletrônica em orbitais do manganês será:
Artigos Relacionados

Últimas notícias
Outras matérias