Eletrólise com Eletrodos Ativos

A eletrólise sempre é feita colocando-se uma substância líquida com íons livres, que pode estar fundida (eletrólise ígnea) ou misturada com água (eletrólise em meio aquoso), num recipiente, denominado de cuba eletrolítica, com dois eletrodos mergulhados nessa substância. São esses eletrodos que estão ligados a um gerador, que pode ser uma pilha ou bateria e que irá permitir a passagem de corrente elétrica pelo composto líquido.
A aplicação principal dos eletrodos é transferir os elétrons das espécies reagentes, por isso, eles não precisam participar da reação. Por exemplo, no esquema abaixo, temos a eletrólise do cloreto de sódio fundido, NaCℓ. Os eletrodos usados foram de grafite, que são inertes, apenas servem para que o sódio metálico e o gás cloro produzidos nas reações de oxirredução se depositem sobre eles e sejam então recolhidos.
.jpg)
Outro material inerte que conduz eletricidade e que é usado como eletrodo é a platina.
Mas existem alguns casos em que os eletrodos participam das reações de oxirredução e, por isso, são chamados de eletrodos ativos.
Veja um exemplo no esquema abaixo, o eletrodo negativo (cátodo) é uma placa de cobre de alta pureza, enquanto o eletrodo positivo (ânodo) é uma placa de cobre metalúrgico, isto é, que contém pequenas quantidades de impurezas, principalmente ferro e zinco, mas também pode conter ouro, prata e platina. Esses eletrodos são colocados numa cuba eletrolítica com uma solução de sulfato de cobre e uma diferença de potencial é aplicada, passando corrente elétrica pelo sistema.
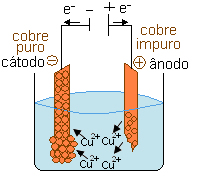
No ânodo (polo positivo), há a retirada de elétrons (descarga) do próprio cobre metálico impuro:
Reação anódica (oxidação): Cu(s)→ Cu2+(aq) + 2e-
No cátodo (polo negativo), há o fornecimento de elétrons (descarga) para os cátions Cu2+(aq).
Reação catódica (redução): Cu2+(aq) + 2e- → Cu0(s)
Isso significa que a placa de cobre metalúrgico se dissolve, sendo que seus cátions Cu2+ se transferem para a solução e são atraídos pela placa de cobre puro, depositando-se sobre ela. Enquanto isso, os cátions das impurezas menos nobres que o cobre, tais como o zinco e o ferro, Zn2+ e Fe2+, não conseguem se reduzir no cátodo porque seu potencial de redução é bem inferior ao dos cátions Cu2+ e, por isso, ficam em solução. Já os cátions das impurezas mais nobres que o cobre, tais como ouro, prata e platina, não se oxidam no ânodo e se depositam no fundo do recipiente.
No cátodo, então, é obtido um cobre com alto teor de pureza. Esse é o procedimento realizado para purificar o cobre metalúrgico, visto que o cobre precisa ter pureza de 99,9% para ser usado, por exemplo, em fios que conduzem energia elétrica.

Somando-se as duas semirreações que ocorrem nos eletrodos, temos:
Semirreação do ânodo: Cu0(s)→ Cu2+(aq) + 2e-
Semirreação do cátodo: Cu2+(aq) + 2e- → Cu0(s)
Reação Global: Zero
O resultado foi zero porque só houve um transporte de cobre da placa impura para a pura, mas não houve transformação química.
Outro exemplo de eletrólise com eletrodos ativos ocorre na Galvanoplastia, um processo em que se reveste uma peça de metal com outro metal mais nobre. Como mostrado abaixo, a peça que será recoberta é o próprio cátodo, já o ânodo deve ser constituído do metal que se deseja revestir a peça. Pode-se usar também no ânodo um eletrodo inerte, e a solução aquosa eletrolítica deve ser feita de um sal do metal que será usado para revestir a peça.
Veja os exemplos abaixo, em que se deseja revestir um anel com ouro. Para tal, colocou-se o anel como sendo o eletrodo negativo (cátodo), uma placa de ouro como eletrodo positivo (ânodo) e ambos estão mergulhados numa solução eletrolítica de nitrato de ouro III [Au(NO3)3], que contém os cátions Au3+.
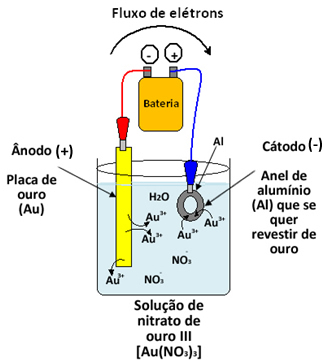
Ao se passar a corrente elétrica pelo sistema, haverá oxidação no ânodo (do próprio ouro metálico (Au)), conforme a semirreação abaixo:
Semirreação do Ânodo: Au → Au3++ 3e-
No cátodo haverá a redução do cátion Au3+ e deposição de ouro sobre o anel, que ficará dourado:
Semirreação do Cátodo: Au3++ 3e- → Au
Somando-se as duas semirreações, vemos que o resultado novamente é igual a zero pelo mesmo motivo explicado anteriormente:
Semirreação do Ânodo: Au → Au3++ 3e-
Semirreação do Cátodo: Au3++ 3e- → Au
Reação Global: Zero
Artigos Relacionados

Últimas notícias
Outras matérias


















