Hidrogênios ionizáveis
Hidrogênios ionizáveis são todos os átomos presentes em uma molécula de um ácido inorgânico ou orgânico, os quais, quando em água, transformam-se no cátion hidrônio (representado por H+ ou por H3O+).
Para identificar ou reconhecer um hidrogênio ionizável de um ácido, é necessário conhecer, antes de mais nada, a classificação dos ácidos quanto à presença ou não de oxigênio:
-
Hidrácidos: são ácidos que apresentam hidrogênio em sua composição;
-
Oxiácidos: são ácidos que apresentam oxigênio em sua composição.
Conhecendo a classificação acima, fica fácil identificar os hidrogênios ionizáveis em qualquer ácido. No caso dos hidrácidos, todo hidrogênio é ionizável, porém, no caso dos oxiácidos, apenas é ionizável o hidrogênio que está ligado a um oxigênio.
Assim, identificando a quantidade de hidrogênios ionizáveis em ácido, podemos classificá-los da seguinte forma:
-
Monoácido: ácido que apresenta um hidrogênio ionizável;
-
Diácido: ácido que apresenta dois hidrogênios ionizáveis;
-
Triácido: ácido que apresenta três hidrogênios ionizáveis;
-
Tetrácido: ácido que apresenta quatro hidrogênios ionizáveis.
Veja a seguir alguns exemplos da determinação do número de hidrogênios ionizáveis em alguns ácidos:
1º Exemplo: Ácido sulfídrico
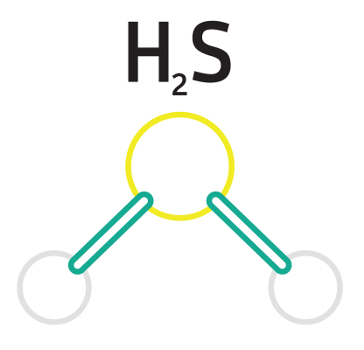
Fórmula estrutural do ácido sulfídrico
O ácido sulfúrico é um hidrácido, logo todos os seus hidrogênios são ionizáveis. Em sua fórmula molecular, podemos perceber a presença de dois átomos de hidrogênios ionizáveis, por isso, o ácido sulfídrico é um diácido.
A equação que representa a ionização desse ácido sempre deve apresentar os dois hidrogênios ionizáveis no produto e o ânion sulfeto (S-2):
H2SO4-2 + 2 H2O → 2 H+ + S-2
2º Exemplo: Ácido sulfúrico
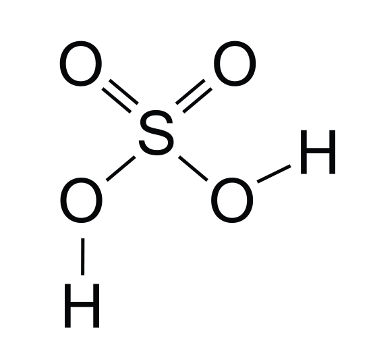
Fórmula estrutural do ácido sulfúrico
O ácido sulfúrico é um oxiácido porque se tornam ionizáveis os hidrogênios ligados a átomo de oxigênio. Em sua estrutura, podemos perceber a presença de dois átomos de hidrogênios ionizáveis e, por isso, o ácido sulfúrico é um diácido.
A equação que representa a ionização desse ácido sempre deve apresentar os dois hidrogênios ionizáveis no produto e o ânion sulfato:
H2SO4-2 + 2 H2O → 2 H+ + SO4-2
3º Exemplo: Ácido fosfórico
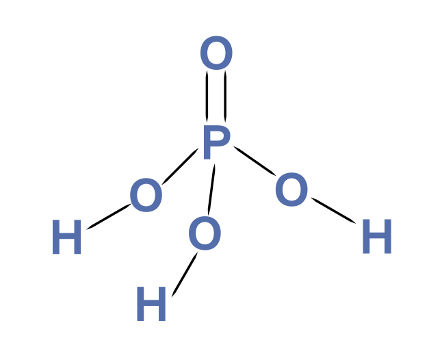
Fórmula estrutural do ácido fosfórico
O ácido fosfórico é um oxiácido, o que significa que os seus hidrogênios estão ligados a átomo de oxigênio. Em sua estrutura, podemos perceber a presença de três átomos de hidrogênios ionizáveis. Por causa disso, o ácido fosfórico é um triácido.
A equação que representa a ionização desse ácido sempre deve apresentar os três hidrogênios ionizáveis no produto e o ânion fosfato:
H3PO4 + 3H2O → 3 H+ + 3PO4-3
Artigos Relacionados

Últimas notícias
Outras matérias


















