Lei de Boyle sobre a transformação isotérmica

As três variáveis de estado dos gases são: pressão, volume e temperatura. As relações entre essas variáveis foram estudadas sempre mantendo uma delas como constante.
De modo independente, o físico e naturalista inglês Robert Boyle (1627-1691) e o físico francês Edme Mariotte (1620-1684) realizaram experimentos de variação da pressão e do volume dos gases com a temperatura constante.
Esse tipo de transformação é denominado isotérmica, pois, do grego, iso significa “igual” e thermo significa “calor”, ou seja, “calor igual”.
Eles observaram uma relação entre pressão e volume que foi quantificada e notaram que essa relação se repetia para todos os gases. Por isso, criou-se a Lei de Boyle, também conhecida como Lei de Boyle-Mariotte que diz o seguinte:
“Em um sistema fechado em que a temperatura é mantida constante, verifica-se que determinada massa de gás ocupa um volume inversamente proporcional a sua pressão.”
Isso significa que se dobrarmos a pressão exercida por um gás em um sistema fechado, o volume irá diminuir pela metade e assim por diante, conforme mostrado na imagem abaixo. O contrário também ocorre, isto é, se diminuirmos a pressão pela metade, o volume ocupado pelo gás será o dobro:
.jpg)
Isso pode ser facilmente visualizado se pegarmos uma bomba de encher pneu de bicicleta, puxarmos o êmbolo totalmente para fora, tamparmos a saída de ar e empurrarmos o êmbolo. Você notará que é possível deslocar o êmbolo um pouco para dentro, aumentando assim a pressão sobre o ar (mistura de gases). Visto que a saída de ar está tampada, conclui-se que a mesma quantidade de ar ocupa agora um volume menor que antes quando o êmbolo estava totalmente puxado para fora.
Quando duas grandezas como essas são inversamente proporcionais, o seu produto é uma constante; desse modo, matematicamente, essa relação pode ser representada assim:
P.V = k
Isso pode ser observado por meio dos dados na tabela abaixo:
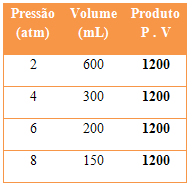
Observe que os valores do produto PV sempre são iguais a 1200, ou seja, é uma constante. Com base nisso ,podemos chegar à seguinte conclusão matemática:
Se:
P1 . V1 = k
e
P2 . V2 = k
Então:
P1 . V1 = P2 . V2
Essa relação matemática pode ser usada para resolver exercícios tais como o exemplo abaixo:
Exemplo: “Considere que em um recipiente com êmbolo móvel, capaz de deslizar sem atrito, contém 20 litros de O2(g) sob pressão de 160 kPa a 298 K. Que volume o gás passará a ocupar se a pressão for reduzida para 80 kPa nessa mesma temperatura?
Resolução:
Basta substituir os valores na equação:
P1 . V1 = P2 . V2
V2 = P1 . V1
P2
V2 = (160 kPa) . (20 L)
(80 kPa)
V2 = 40 L
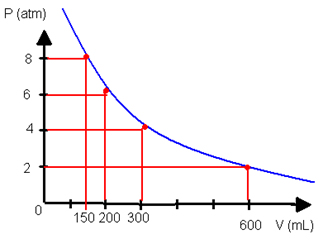
Se representarmos as transformações isotérmicas por meio de um gráfico, veremos que para a mesma massa do gás, o produto das variáveis de pressão e volume sempre originará uma hipérbole.
Veja um exemplo de gráfico assim com os dados que foram fornecidos na tabela mencionada anteriormente:
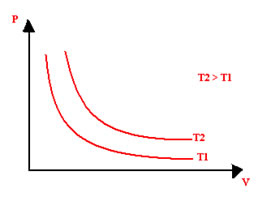
Diferentes temperaturas originam diferentes hipérboles, que são chamadas de isotermas.
Artigos Relacionados

Últimas notícias
Outras matérias


















