Metais nobres

Metais nobres são elementos químicos que apresentam uma menor reatividade quando comparados a outros elementos químicos de natureza metálica. O ferro, por exemplo, reage facilmente com o oxigênio, o que não acontece com o elemento ouro. Por esse motivo, o ouro é considerado mais nobre que o ferro.
Como os metais nobres apresentam reatividade pequena, eles possuem uma maior resistência a sofrer oxidação (perda de elétrons) e redução (ganho de elétrons). É muito comum vermos uma palha de aço oxidar (corroer-se, mudar de cor) na cozinha, mas dificilmente vemos isso acontecer com uma aliança de ouro.
Os elementos que são considerados metais nobres são: ouro, prata, platina, paládio e cobre. Veja suas principais características e aplicações:
→ Ouro

Pequenas pepitas de ouro
Características atômicas do Ouro:
-
Seu símbolo é Au;
-
O número atômico é 79;
-
Sua massa atômica é 196,96 g/mol;
-
Núcleo possui 79 prótons;
-
Níveis de energia possuem 79 elétrons;
-
O número de nêutrons no núcleo é 118, pois existe apenas um isótopo natural desse elemento;
-
Pertence ao 6o período da família IB da Tabela Periódica;
-
Possui tendência de perder um ou três elétrons, formando, então, cátions monovalentes (Au1+) e trivalentes (Au3+).

-
Subnível mais externo é o 6s2
-
Subnível mais energético é o 5d9
Características físicas do Ouro
-
Seu ponto de fusão é 1064 oC;
-
Seu ponto de ebulição é 2970 oC;
-
Sua densidade é de 19,3 g/cm3;
-
Apresenta coloração amarelada;
-
Não é solúvel em água;
-
É solúvel em mercúrio e em água*régia (mistura formada pelos ácidos nítrico e clorídrico).
Formas de obtenção
É um elemento que está amplamente distribuído na crosta terrestre. Pode ser encontrado também no fundo dos oceanos (estudos apontam que existe uma grande quantidade de ouro nos mares).
Por ser um material inerte, o ouro pode ser encontrado livre na natureza ou associado a alguns minérios, como quartzo e piririta. Na forma mineral, é encontrado em grande quantidade no minério calverita.
Principais utilizações
-
Construção de barras de ouro para reservas monetárias dos países;
-
Produção de joias;
-
Cobre janelas em edifícios para refletir a radiação infravermelha e evitar o aquecimento do cômodo;
-
Em computadores, em virtude da alta capacidade de condução de corrente elétrica;
-
Nas restaurações dentárias;
-
Dispositivos para diagnóstico de gravidez;
-
Tratamento de alguns tipos de câncer.
→ Prata

Talheres confeccionados com o metal prata
Características atômicas
-
Seu símbolo é Ag;
-
O número atômico é 47;
-
Sua massa atômica é 107,88 g/mol;
-
Núcleo possui 47 prótons;
-
Níveis de energia possuem 47 elétrons;
-
O número de nêutrons no núcleo pode variar de 60 a 62, pois existem apenas dois isótopos naturais desse elemento;
-
Pertence ao quinto período da família IB da Tabela Periódica;
-
Possui a tendência de perder um elétron, formando, então, cátions monovalentes (Ag1+).
Distribuição eletrônica

-
Subnível mais externo é o 5s2
-
Subnível mais energético é o 4d9
Características físicas
-
Seu ponto de fusão é 960,8 oC;
-
Seu ponto de ebulição é 2210 oC;
-
Sua densidade é 10,5 g/cm3
-
Apresenta coloração prateada;
-
Não é solúvel em água;
-
É solúvel em ácido nítrico.
Formas de obtenção
A prata é um metal abundante na crosta terrestre e está presente em mais de 60 tipos de minérios diferentes, como a argentita.
Principais utilizações
-
Produção de fios condutores de eletricidade;
-
Produção de joias;
-
Produção de utensílios de cozinha;
-
Produção de instrumentos musicais;
-
Produção de alguns medicamentos;
-
Produção de baterias de alta capacidade;
-
Produção de explosivos.
→ Platina

Minério com platina
Características atômicas
-
Seu símbolo é Pt;
-
O número atômico é 78;
-
Sua massa atômica é 195,08 g/mol;
-
Núcleo possui 78 prótons;
-
Níveis de energia possuem 78 elétrons;
-
O número de nêutrons no núcleo pode variar de 112 a 120, pois a platina apresenta seis isótopos naturais;
-
Pertence ao sexto período da família VIIIB da Tabela Periódica;
-
Possui tendência de perder 2 ou 4 elétrons, formando cátions bivalentes (Pt2+) e tetravalentes (Pt4+).
Distribuição eletrônica

-
Subnível mais externo é o 6s2
-
Subnível mais energético é o 5d8
Características físicas
-
Seu ponto de fusão é 1769 oC;
-
Seu ponto de ebulição é 3825 oC;
-
Sua densidade é 21,45 g/cm3;
-
Apresenta coloração prateada;
-
Não é solúvel em água;
Não pare agora... Tem mais depois da publicidade ;) -
É solúvel em água-régia.
Formas de obtenção
A platina é um metal pouco abundante na crosta terrestre, estando mais associada a alguns minérios que apresentam os metais cobre e níquel. Porém, o principal minério que apresenta platina é a chamada sperrilita (PtAs2). A separação da platina dos minérios onde é encontrada ocorre geralmente por meio de um processo denominado de refinamento eletrolítico.
Principais utilizações
-
Confecção de joias;
-
Produção de catalisadores (substância que acelera a reação) de reações orgânicas;
-
Indústria petroquímica;
-
Produção de materiais para restauração dentária;
-
Fabricação de alguns medicamentos.
→ Mercúrio

Gotas do metal líquido mercúrio
Características atômicas
-
Seu símbolo é Hg;
-
O número atômico é 80;
-
Sua massa atômica é 200,59 g/mol;
-
Núcleo possui 80 prótons;
-
Níveis de energia possuem 80 elétrons;
-
O número de nêutrons no núcleo pode variar de 116 a 124, pois apresentar sete isótopos naturais;
-
Pertence ao sexto período da família IIB da Tabela Periódica;
-
Possui tendência de perder 1 ou 2 elétrons, formando cátions monovalentes (Hg21+) e bivalentes (Hg2+).
Distribuição eletrônica

-
Subnível mais externo é o 6s2
-
Subnível mais energético é o 5d10
Características físicas
-
Seu ponto de fusão é -38,8 oC;
-
Seu ponto de ebulição é 356,7 oC;
-
Sua densidade é 13 g/cm3;
-
Apresenta coloração prateada;
-
Não é solúvel em água.
Formas de obtenção
O mercúrio é um metal abundante na natureza, estando muitas vezes associado ao enxofre, formando o minério cinabre. A obtenção do mercúrio a partir do cinabre ocorre pelo simples aquecimento do mineral.
Principais utilizações
-
Aparelhos de medição, como termômetros, barômetros etc.;
-
Produção de agentes resfriantes para componentes eletrônicos;
-
Produção de cloro e soda cáustica.
-
Na produção de
→ Paládio

Barras confeccionadas com o metal paládio
Características atômicas
-
Seu símbolo é Pd;
-
O número atômico é 46;
-
Sua massa atômica é 106,42 g/mol;
-
Núcleo possui 46 prótons;
-
Níveis de energia possuem 46 elétrons;
-
O número de nêutrons no núcleo pode variar de 56 a 64, pois o paládio apresentar seis isótopos naturais;
-
Pertence ao quinto período da família VIIIB da Tabela Periódica;
-
Possui tendência de perder 1, 2 ou 4 elétrons, formando cátions monovalentes (Pd1+), bivalentes (Pd2+) e tetravalentes (Pd4+).
Distribuição eletrônica

-
Subnível mais externo é o 5s2
-
Subnível mais energético é o 4d8
Características físicas
-
Seu ponto de fusão é 1554 oC;
-
Seu ponto de ebulição é 2963 oC;
-
Sua densidade é 12,02 g/cm3;
-
Apresenta coloração branca prateada
-
Não é solúvel em água;
-
É solúvel em alguns ácidos e bases inorgânicos, assim como na água-régia
Formas de obtenção
O paládio é um metal bastante escasso na crosta terrestre, sendo encontrado em minérios de níquel, platina e cobre. Sua separação dos minérios onde é encontrado é feita por purificação eletrolítica.
Principais utilizações
-
Produção de catalisadores para reações orgânicas;
-
Produção de joias;
-
Produção de componentes eletrônicos para computadores, televisores, celulares etc.
-
Produção dos ácidos nítrico e tereftálico.
→ Cobre

Fios elétricos feitos com cobre
Características atômicas
-
Seu símbolo é o Cu;
-
O número atômico é 29;
-
Sua massa atômica é 63,546 g/mol;
-
Núcleo possui 29 prótons;
-
Níveis de energia possuem 29 elétrons;
-
O número de nêutrons no núcleo pode variar de 34 a 36;
-
Pertence ao quarto período da família IB da Tabela Periódica;
-
Possui tendência de perder 1 ou 2 elétrons, formando cátions monovalentes (Cu1+) e bivalentes (Cu2+).
Distribuição eletrônica
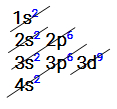
-
Subnível mais externo é o 4s2
-
Subnível mais energético é o 3d9
Características físicas
-
Seu ponto de fusão é 1085 ºC
-
Seu ponto de ebulição é 2562 ºC;
-
Sua densidade é 8,98 g/cm3;
-
Apresenta coloração avermelhada;
-
Não é solúvel em água;
-
É solúvel em diferentes ácidos inorgânicos.
Formas de obtenção
O cobre é encontrado geralmente nos minérios calcocita, calcopirita e malaquita e na pedra preciosa turquesa. Sua obtenção é feita pela eletrólise desses materiais e, em seguida, um aquecimento para provocar sua fusão.
Principais utilizações
-
Produção de fios condutores de eletricidade;
-
Confecção de moedas;
-
Confecção de obras de arte;
-
Confecção de joias;
-
Confecção de peças de automóveis, carros e aviões;
-
Produção de geradores, transformadores e outros equipamentos para sistemas elétricos;
-
Produção de proteínas e enzimas no organismo humano.
Artigos Relacionados

Últimas notícias
Outras matérias


















