Pilhas de mercúrio

As pilhas de mercúrio ou de mercúrio-zinco recebem esse nome porque são constituídas basicamente de:
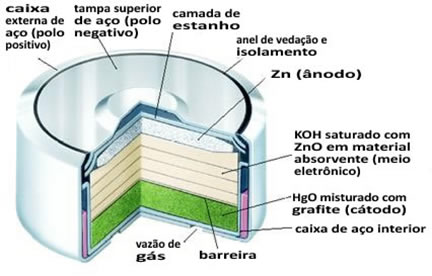
Ânodo (polo negativo): cápsula de zinco.
Cátodo (polo positivo): pasta que envolve o ânodo que contém óxido de mercúrio II (HgO (s)), no qual o mercúrio se reduz de + 2 para 0.
Essa pilha é alcalina, pois contém como solução eletrolítica o hidróxido de potássio (KOH(aq) ), que é uma base fortemente alcalina, que substitui o NH4Cl das pilhas secas comuns.
As semirreações que ocorrem em seus eletrodos e sua reação global estão descritas abaixo:
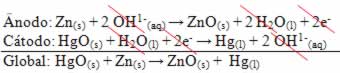
Outro nome pelo qual essas pilhas são conhecidas é pilha de Ruben-Mallory.
Essas pilhas costumam ser bem pequenas, pois tanto o zinco como o óxido de mercúrio II são transformados em pó e compactados (veja a figura abaixo, em que há uma comparação do seu tamanho com uma moeda de dez centavos). Desse modo, elas são usadas em aparelhos de pequenas dimensões.

Outros benefícios do seu uso são a sua grande durabilidade e voltagem eficiente, sendo de 1,35 V. Por isso, elas são muito utilizadas nos seguintes aparelhos: relógios, máquinas fotográficas, calculadoras, agendas eletrônicas, aparelhos de audição, e outros aparelhos eletrônicos.
Artigos Relacionados

Últimas notícias
Outras matérias


















