Pilhas ou Células Eletroquímicas

No nosso cotidiano é muito difícil passarmos um dia sequer sem entrarmos em contato com equipamentos eletroeletrônicos, tais como celulares, câmaras fotográficas, filmadoras, brinquedos, relógios, aparelhos de som e assim por diante. Mas, para todos esses equipamentos funcionarem é preciso o uso de pilhas e baterias bem leves e pequenas.
Isso nos mostra que as pilhas possuem um papel importante em nossa sociedade e que a descoberta das pilhas e o seu desenvolvimento representou um grande avanço tecnológico.
Mas, o que é uma pilha? Como funciona esse dispositivo? Que tipo de reação ocorre dentro dela que consegue gerar energia elétrica?
A Eletroquímica, um dos ramos de estudos da Química, responde a essas perguntas. As pilhas ou células eletroquímicas podem ser definidas como:
“Dispositivos capazes de transformar energia química em energia elétrica por meio de reações espontâneas de oxirredução (em que há transferência de elétrons).”
As baterias também realizam esse mesmo processo, porém, a diferença está no fato de que as pilhas possuem apenas um eletrólito (solução condutora de íons também denominada de ponte salina) e dois eletrodos. Já a bateria é composta de várias pilhas agrupadas em série ou em paralelo. Além disso, as pilhas não são recarregáveis, mas as baterias são.
Portanto, numa pilha sempre ocorrerão reações de oxirredução e ela terá os seguintes componentes:
1- Dois eletrodos:
1.1 – Ânodo: É o polo negativo, sofre oxidação porque perde elétrons e é o agente redutor.
1.2 - Cátodo: É o polo positivo, sofre redução por ganhar elétrons e é o agente oxidante.
As pilhas são representadas da seguinte forma:
Ânodo // Cátodo
Oxidação // redução
A → Ax+ + x e- // Bx+ + x e- → B
2- Uma solução eletrolítica: Também chamada de ponte salina, tem a finalidade de manter as duas semicelas eletricamente neutras através da migração de íons.
// → representa a ponte salina.
3- Fio metálico externo: Por meio dele os eletrodos são conectados e há a transferência de elétrons.
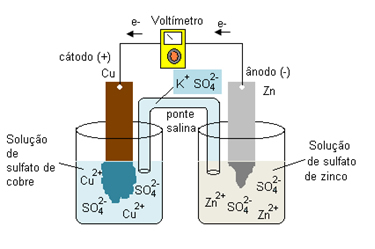
Por exemplo, podemos montar uma pilha colocando uma solução de sulfato de cobre (CuSO4) num copo e mergulhando nessa solução uma placa de cobre. Em outro copo, colocamos uma solução de sulfato de zinco (ZnSO4) e mergulhamos uma placa de zinco. Depois, conectamos as soluções por meio de uma ponte salina, que pode ser um tubo contendo uma solução eletrolítica com os íons K+(aq) e SO42-(aq) ou uma placa de porcelana porosa. Por fim, conectamos as placas metálicas por meio de um fio de cobre com um voltímetro (que indicará a passagem de corrente elétrica). O sistema ficará da seguinte forma:
.jpg)
Com o tempo, notaremos que o zinco metálico (Zn(s)) se oxidará, perdendo seus elétrons, que serão transferidos para a placa de cobre. Consequentemente, o cobre se reduzirá, recebendo os elétrons. Portanto, o zinco será o polo negativo (ânodo) e o cobre será o polo positivo (cátodo). As semirreações que ocorrerão em cada eletrodo são dadas por:
Semirreação no ânodo: Zn( s) ↔ Zn2+(aq) + 2 e-
Semirreação no cátodo: Cu2+(aq) + 2 e- ↔ Cu( s)
Reação Global: Zn( s) + Cu2+(aq) ↔ Zn2+(aq) + Cu( s)
Podemos representar essa pilha do seguinte modo:
Zn / Zn2+// Cu2+ / Cu
Artigos Relacionados

Últimas notícias
Outras matérias


















