Ruptura de ligações
A ruptura de ligações entre átomos pode ocorrer de modo homogêneo ou heterogêneo.
Ruptura Homolítica: a molécula é separada de modo igual para os radicais resultantes, ou seja, é uma cisão de ligação sem perda nem ganho de elétrons.
Quando a quebra da ligação é feita igualmente, cada átomo fica com seu elétron original da ligação, dando origem aos chamados radicais livres.
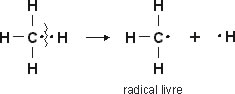
Radical livre: átomo com elétron desemparelhado, cuja carga elétrica é neutra.
Ruptura Heterolítica: a quebra da ligação é feita de modo desigual, ficando o par eletrônico com apenas um dos átomos da ligação.
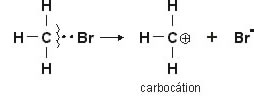
Observe que uma das espécies ganha elétrons e a outra perde (formação de íons).
Rompendo-se heteroliticamente a ligação entre carbono e bromo, teremos um carbocátion e um íon brometo (ânion). Neste caso, o elemento bromo, como sendo mais eletronegativo, leva consigo o par eletrônico.
Mas o que aconteceria se o par de elétrons ficasse com o Carbono? Isto ocorre quando há uma quebra heterolítica entre a ligação de carbono e hidrogênio:
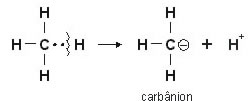
O carbono fica com o par eletrônico e colabora para a formação de um carbânion e um íon H+ (próton).
Veja mais!
Ligação iônica e covalente
Artigos Relacionados

Últimas notícias
Outras matérias


















