Tabela periódica
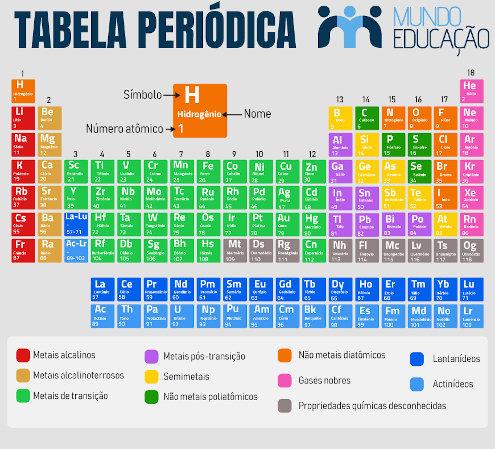
A tabela periódica é uma forma de organização dos elementos químicos em ordem crescente de número atômico e de recorrência de suas propriedades físico-químicas.
A classificação dos elementos em formato de tabela foi proposta por Dmitri Mendeleev em 1869, o qual foi responsável por identificar e agrupar elementos químicos com propriedades similares em uma mesma coluna. Inicialmente, Mendeleev utilizou a massa atômica como critério de organização dos elementos. Porém, em 1913, Henry Moseley descobriu o número atômico, e a tabela periódica passou a ser ordenada de acordo com o número crescente de prótons no átomo, assumindo a configuração atual.
A disposição dos elementos na tabela periódica permite reconhecer a tendência de variação de algumas de suas propriedades físico-químicos ao longo de um grupo ou de um período da tabela.
Leia também: Evolução dos modelos atômicos
Resumo sobre a tabela periódica
-
A tabela periódica organiza os elementos químicos em ordem crescente de número atômico.
-
Todos os 118 elementos químicos estão distribuídos ao longo de 18 grupos e sete períodos.
-
Os grupos são as colunas da tabela periódica e reúnem elementos com propriedades similares e igual número de elétrons de valência.
-
Os períodos são as linhas da tabela periódica e acomodam elementos com o mesmo número de camadas eletrônicas ocupadas.
-
A disposição dos elementos na tabela revela algumas propriedades que se repetem de forma recorrente, sendo chamadas de propriedades periódicas.
-
As principais propriedades periódicas são o raio atômico, a energia de ionização, a afinidade eletrônica, a eletronegatividade, a densidade e os pontos de fusão e de ebulição.
-
Apesar de a criação da tabela periódica ser atribuída a Dmitri Mendeleev, a sua concepção teve contribuição de diversos estudiosos.
-
A tabela periódica é uma ferramenta essencial ao desenvolvimento da ciência e está em constante evolução.
Organização da tabela periódica
A tabela periódica moderna é composta por 118 elementos e é organizada de acordo com o número atômico de cada espécie, em ordem crescente, da esquerda para a direita. Os elementos são distribuídos ao longo de 18 grupos, representados pelas colunas verticais, e em sete períodos, que são as linhas horizontais.
Essa configuração foi proposta por Dmitri Mendeleev, em 1869, depois de ele ter notado padrões entre os elementos químicos e percebido que poderia agrupá-los conforme tais similaridades. Assim, apenas pela localização de um elemento na tabela periódica, é possível conhecer algumas de suas características químicas.
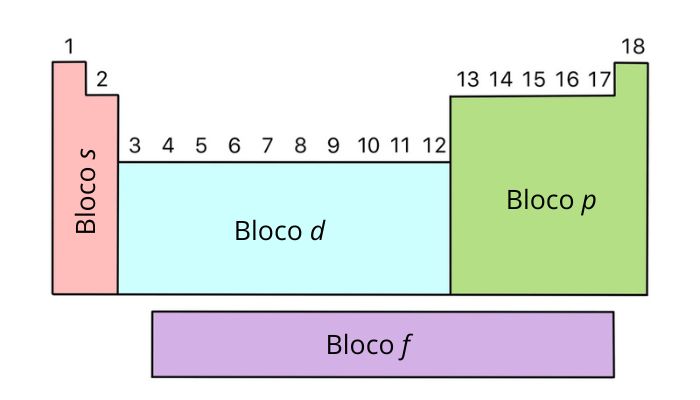
A tabela periódica ainda pode ser organizada em blocos que se relacionam à distribuição eletrônica dos elementos. Nessa abordagem, a tabela é dividida de acordo com o subnível ocupado de maior energia, ou seja, a subcamada que contém os elétrons mais externos.
TABELA INDICATIVA DA DIVISÃO DA TABELA PERIÓDICA EM BLOCOS.
|
Bloco |
Subnível mais energético |
Quem faz parte? |
|
s |
s |
Grupos 1 e 2 |
|
p |
p |
Grupos 13 a 18 |
|
d |
d |
Grupos 3 a 12 |
|
f |
f |
Séries dos lantanídeos e actinídeos |
De modo mais amplo, os elementos podem ser ainda divididos em metais e não-metais, de acordo com características físico-químicas. Os metais englobam a maior parte dos elementos e ainda se dividem em subclasses. Em geral, são aqueles que possuem brilho e condutividade térmica e elétrica. Os não-metais, ou ametais, incluem apenas 11 elementos químicos: carbono, nitrogênio, fósforo, oxigênio, enxofre, selênio, flúor, cloro, bromo, iodo e astato.
Por fim, os constituintes da tabela ainda podem serem divididos entre elementos de transição e elementos representativos, contudo essa classificação vem sendo pouco utilizada. Elementos representativos estão presentes nas extremidades esquerda e direita da tabela, englobando os grupos 1, 2, 14, 15, 16, 17 e 18. Já os elementos de transição são aqueles situados na região central, englobando os grupos 3 a 11.
O grupo 12 é comumente classificado como elemento de transição, no entanto é importante destacar que esse grupo não cumpre os requisitos para isso, que seria possuir um subnível d incompleto.
Veja também: Quais são os elementos radioativos?
Famílias ou grupos da tabela periódica
A tabela periódica é dividida em 18 grupos, compostos por elementos com propriedades físico-químicas similares e padrão bem definido em suas propriedades periódicas. São referidos pela própria numeração (1 a 18) ou por alguns nomes específicos (veja tabela abaixo).
O elemento hidrogênio é um caso particular. Apesar de estar localizado no grupo 1, ele não possui propriedades semelhantes aos demais elementos desse grupo.
Uma característica comum e importante dos elementos químicos que compõem cada grupo é possuir a mesma quantidade de elétrons na camada de valência. O número de elétrons de valência é uma importante característica química, pois define a estabilidade e a reatividade de um elemento químico.
Por exemplo, os elementos do grupo 1 possuem apenas um elétron na camada de valência, já os elementos do grupo 18 possuem a valência completa, isto é, oito elétrons. Na prática, isso significa que os elementos do grupo 18 são menos reativos e mais estáveis do que os elementos do grupo 1.
Para se referir aos grupos, é comum usar sua numeração, o nome do primeiro elemento ou ainda alguns nomes específicos, que foram sendo cunhados com o tempo em razão das propriedades ou origem natural dos elementos.
TABELA INDICANDO CARACTERÍSTICAS DOS GRUPOS DA TABELA PERIÓDICA
|
Número do grupo |
Nome |
Número de elétrons de valência |
|
1 |
Metais alcalinos |
1 |
|
2 |
Metais alcalinoterrosos |
2 |
|
3-12 |
Metais de transição |
2 |
|
13 |
— |
3 |
|
14 |
— |
4 |
|
15 |
— |
5 |
|
16 |
Calcogênios |
6 |
|
17 |
Halogênios |
7 |
|
18 |
Gases nobres |
8 |
Antes, era comum utilizar os termos grupo e família como sinônimos e as letras A e B para se referir aos lados esquerdo e direito da tabela. Atualmente, o termo “grupo” deve prevalecer para se referir às colunas da tabela periódica, e não se usa mais as denominações A e B, sendo os grupos numerados de 1 a 18.
Períodos da tabela periódica
A tabela periódica é composta por sete períodos, suas linhas horizontais, que acomodam os elementos químicos em sentido crescente de número atômico.
Um mesmo período acomoda elementos que possuem igual número de camadas eletrônicas ocupadas. Ao descer pela tabela, um novo período é iniciado quando um elétron passa a ocupar o próximo nível eletrônico do átomo.
Os lantanídeos são um conjunto de elementos localizados no período 6 da tabela periódica, que se iniciam no elemento lantânio (Z = 57) e se estendem até o lutécio (Z = 71). Por razões estéticas, na tabela periódica convencional, esses elementos são mostrados abaixo da tabela, compondo o bloco f. Estratégia similar foi adotada para os actinídeos, conjunto de elementos do período 7 que se inicia no elemento actínio (Z = 89) e vai até o laurêncio (Z = 103). A série dos lantanídeos e actinídeos é chamada de “metais de transição interna”.
Quais são as propriedades periódicas?
A organização da tabela periódica no sentido crescente de número atômico, dentro de grupos e períodos, revela algumas propriedades dos elementos químicos que ocorrem de forma de forma recorrente, a depender da sua localização na tabela.
É por isso que a tabela periódica dos elementos tem esse nome, pelo fato de algumas propriedades se repetirem de maneira periódica dentro dos grupos e períodos.
-
Raio atômico
O tamanho do átomo pode ser expresso pelo seu raio atômico. Na realidade, é difícil determinar seu tamanho pelo fato de a eletrosfera não possuir um limite definido.
No entanto, para que se possa ter uma ideia de qual é o tamanho do átomo, considera-se o seu raio atômico como sendo a distância entre o elétron mais externo e o núcleo. O raio atômico é normalmente expresso em unidade de picômetros (pm), sendo 1 pm = 10-12m.
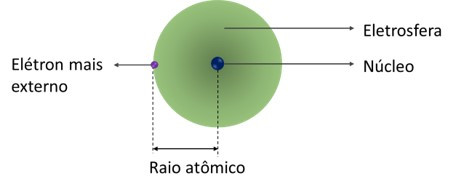
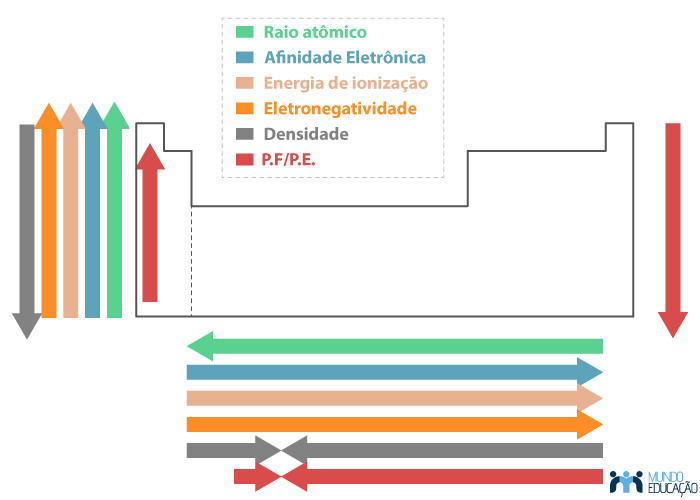
Dentro da tabela periódica, o raio atômico dos elementos aumenta dentro de um grupo, de cima para baixo, em razão do aumento do número de camadas preenchidas por elétrons.
Dentro de um período, todos os elementos ocupam o mesmo nível atômico, mas com número crescente de prótons da esquerda para a direita. Conforme mais prótons há no núcleo, maior será a força de atração entre os elétrons e o núcleo, fenômeno conhecido como carga nuclear. Isso ocasiona uma contração da eletrosfera e, portanto, uma diminuição do raio atômico.
Por isso, dentro de um período, o raio atômico diminui da esquerda para a direita, em função do aumento do número atômico.
-
Energia de ionização ou potencial de ionização
A energia de ionização é a energia necessária para remover um elétron de valência de um átomo gasoso e isolado, em seu estado fundamental, convertendo-o em um íon positivo. Veja um exemplo para o átomo de sódio (Na):
Na g + energia absorvida → Na+g + elétron
Quanto menor o átomo (menor raio atômico), maior será a energia necessária para remover um elétron de valência. Isso é explicado porque átomos menores possuem carga nuclear maior, ou seja, sentem mais fortemente a atração entre o núcleo e os elétrons.
Dentro do grupo, a energia de ionização aumenta de baixo para cima. Quanto menor o raio atômico, maior a energia para remover o elétron, em razão da maior carga nuclear.
Dentro do período, a energia de ionização aumenta da esquerda para a direita. Quanto menor for o átomo, maior será a força de atração do núcleo, fator que eleva a energia de ionização.
Na tabela periódica, a propriedade de energia de ionização se altera inversamente à variação do raio atômico, pois quanto menor o átomo, maior a energia requerida para a remoção de um elétron.
-
Afinidade eletrônica ou eletroafinidade
A afinidade eletrônica é a energia liberada pelo átomo gasoso quando recebe um elétron para formar um íon negativo, estando isolado e em seu estado fundamental. Veja um exemplo para o átomo de cloro (Cl):
Cl g +elétron → Cl-g + energia liberada
Em um grupo, a afinidade eletrônica aumenta de baixo para cima, porque quanto mais perto o elétron adicional ficar do núcleo, maior será a força de atração sentida por ele e, assim, maior será a energia liberada.
Para o período, a afinidade eletrônica é maior da esquerda para a direita. Isso se explica pelo aumento do número atômico, exercendo maior carga nuclear atrativa sobre os elétrons.
Na tabela periódica, a propriedade de afinidade eletrônica se altera inversamente à variação do raio atômico, pois mais energia é liberada quando um elétron é recebido por átomos menores.
-
Eletronegatividade
A eletronegatividade se relaciona com a tendência de um átomo em atrair elétrons quando participa de uma ligação química, ou seja, quando está ligado a outro elemento.
Átomos de menor raio atômico são mais eletronegativos, ou seja, conseguem atrair os elétrons de outro elemento ligado a ele com maior intensidade. Dentro do grupo, a eletronegatividade aumenta de baixo para cima. Dentro do período, a eletronegatividade aumenta da esquerda para a direita.
-
Densidade
A densidade de uma substância é a relação entre a sua massa e o volume ocupado por ela.
Quando se fala em densidade dos elementos, na realidade, estamos falando da substância mais simples formada por cada elemento. E assim como as demais propriedades periódicas, a densidade se altera com o número atômico.
Em um grupo, a densidade cresce de baixo para cima, em razão da elevação do número atômico. Em um período, a densidade aumenta das extremidades para o centro. O elemento ósmio possui o maior valor de densidade dentre os elementos — igual a 22,6 g/cm3.
-
Ponto de fusão e ponto de ebulição
O ponto de fusão é a temperatura necessária para que um sólido se transforme em um líquido. O ponto de ebulição é a temperatura em que um líquido passa para o estado gasoso.
Na tabela periódica, essas duas propriedades variam com o número atômico, aumentando dentro de um período das extremidades para o centro. Já dentro de um grupo, os pontos de fusão e ebulição crescem de cima para baixo.
No entanto, os elementos dos grupos 1 (metais alcalinos) e 2 (metais alcalinoterrosos) têm um comportamento diferente, sendo que seus pontos de fusão e ebulição aumentam de baixo para cima dentro do grupo, ou seja, no sentido de diminuição do raio atômico.
A imagem abaixo resume a tendência de variação das propriedades periódicas ao longo dos grupos e períodos tabela periódica:
História da tabela periódica
Conforme o número de elementos químicos descobertos pelo homem crescia ao longo das décadas, houve uma tendência natural dos cientistas em organizá-los em uma determinada ordem, buscando correlações entre eles. Diversas tentativas e propostas foram apresentadas, discutidas e melhoradas a partir da segunda metade do século XIX.
O químico alemão Johann Wolfgang Döbereiner foi um dos primeiros a reconhecer a existência de similaridades entre alguns elementos químicos. Em 1829, Döbereiner aperfeiçoou sua teoria e propôs que alguns elementos poderiam ser divididos em tríades (conjunto de três elementos) com forte semelhança em suas massas atômicas.
Pouco tempo depois, em 1862, o geólogo francês Alexandre Émile Béguyer de Chancourtois organizou os elementos químicos conhecidos em sentido crescente de seus pesos atômicos em uma configuração geométrica interessante. Chancourtois dispôs os elementos em um formato cilíndrico, organizados em uma hélice e divididos em 16 seções. Esse arranjo ficou conhecido como parafuso telúrico (o termo “telúrico” se refere à Terra). Os químicos da época não deram muita importância a essa proposta, pois ela foi apresentada dentro de um contexto geológico.
Na mesma época, o químico inglês John Alexander Reina Newlands apresentou uma nova e elegante proposta de arranjo dos elementos químicos, em uma ordem que lembrava os intervalos das notas musicais. Nesse arranjo, linhas horizontais continham sete elementos, e o oitavo elemento, que possuía propriedades similares às do primeiro, ficava posicionado abaixo, iniciando uma nova sequência. Essa configuração foi chamada de lei das oitavas. Os cientistas da época não levaram Newlands a sério, porém décadas mais tarde, sua contribuição foi reconhecida oficialmente pela identificação da periodicidade das propriedades dos elementos químicos.
Em 1869, o químico russo e professor universitário Dmitri Mendeleev, durante o processo de escrita de um livro de Química, organizou os 63 elementos químicos conhecidos até então em fichas individuais, contendo todas as propriedades conhecidas de cada um deles. Manipulando esse material para escrever seu livro, ele notou que quando os elementos estão organizados em ordem crescente de massa atômica, algumas propriedades se repetem de maneira regular, assim como a lei das oitavas de Newland previa.
Com esses dados, Mendeleev organizou os elementos químicos em formato de tabela, deixando todos aqueles com propriedades semelhantes em uma mesma coluna. No entanto, o maior destaque para a proposta de Mendeleev foi a percepção de que faltavam alguns elementos para completar as colunas. Por isso, em sua tabela, ele deixou espaços vagos, considerando que à época ainda nem todos os elementos haviam sido descobertos. Como ele já sabia que as propriedades se repetiam de forma periódica, Mendeleev ainda fez previsões sobre as propriedades que esses futuros elementos deveriam apresentar.

Outro ponto de destaque foi o professor russo perceber que em alguns pontos da tabela seria mais adequado haver algumas inversões na posição dos elementos, para que as propriedades se mantivessem no padrão de recorrência.
Alguns anos mais tarde, em 1913, o físico Henry Moseley fez importantes avanços científicos utilizando a técnica de raios-X — dentre eles, o estabelecimento da característica que atualmente conhecemos como número atômico e que se refere à quantidade de prótons no núcleo. Moseley também determinou que as propriedades físicas e químicas de elementos dependem do número atômico.
Com essa descoberta, a tabela proposta por Mendeleev foi readequada utilizando os valores crescentes de número atômico (e não mais de massa atômica), e foi verificada a ocorrência da periodicidade nas propriedades dos elementos químicos que se repetem com regularidade. Esse fenômeno é conhecido como Lei Periódica dos Elementos.
Com o avanço tecnológico, outros cientistas fizeram ajustes às propostas de Medeleev e de Moseley para a tabela periódica, mas as ideias centrais apresentadas por eles são a base da tabela periódica moderna.
Em junho de 2016, quatro novos elementos foram adicionados à tabela periódica, que atualmente (2022) conta com 118 elementos químicos conhecidos.
-
Videoaula sobre a história da tabela periódica
Curiosidades sobre a tabela periódica
-
Dmitri Mendeleev, apesar de levar a fama de criador da tabela periódica, não é o único responsável por sua criação. Como descrito no tópico “História da tabela periódica”, outros pesquisadores antes de Mendeleev já haviam notado a presença de periodicidade das propriedades. Além disso, a tabela periódica é uma ferramenta científica que está em constante evolução.
-
Em 2016, foram adicionados quatro novos elementos à tabela periódica: nihonio (Z = 113), moscovio (Z = 115), tennessino (Z = 117) e oganesson (Z = 118). Esses elementos completam o período 7. Agora, se novos elementos forem descobertos, eles deverão iniciar um novo período na tabela.
-
Dos 118 elementos que formam a tabela periódica, 94 são de ocorrência natural.
-
A maioria dos elementos da tabela periódica são metais — quase 75%.
-
A principal diferença da tabela periódica moderna para a tabela proposta por Mendeleev é que, atualmente, a tabela periódica é organizada em ordem crescente de números atômicos, e não de massas atômicas.
-
Há alguns rumores no meio científico de que Mendeleev conseguiu organizar os elementos no formato da tabela periódica após ter tido um sonho.
-
Por ser um apreciador de jogos de cartas, diz-se que a inspiração para Mendeleev organizar os elementos com propriedades semelhantes em uma mesma coluna foi o jogo conhecido como Paciência.
-
Mendeleev usou a tabela periódica para prever a descoberta de novos elementos químicos. Contudo, ele negou a existência de alguns elementos que já eram conhecidos na época pelo fato de eles, aparentemente, não se encaixarem na tabela por ele desenhada. Isso ocorreu para o caso do grupo dos gases nobres.
-
Alguns elementos foram nomeados em homenagem a cientistas e aos lugares em que foram descobertos. O elemento einstenium homenageia Albert Einstein. O elemento germânio faz referência ao seu lugar de descoberta, a Alemanha.
-
Na tabela periódica existem apenas dois elementos que são líquidos à temperatura ambiente, o mercúrio (Hg) e o bromo (Br).
-
Em 2019, foi comemorado o Ano Internacional da Tabela Periódica, tamanha a sua importância para a ciência.
Leia também: Descoberta da primeira partícula subatômica: o elétron
Exercícios sobre a tabela periódica
Questão 1
(IFF 2016) A base da tabela periódica atual é organizada segundo a ordem crescente do número atômico dos elementos químicos. Na tabela periódica, as colunas (verticais) são chamadas de grupos (famílias), enquanto as linhas (horizontais) são chamadas de períodos da tabela periódica. Tendo por base a organização da tabela periódica e as propriedades dos elementos químicos, assinale a alternativa correta.
A) O número atômico de um elemento químico corresponde à quantidade de nêutrons de seu átomo.
B) Em um mesmo período da tabela periódica, encontramos elementos químicos contendo o mesmo número de camadas eletrônicas.
C) As colunas (verticais) da tabela periódica reúnem elementos com propriedades químicas muito diferentes.
D) Por meio da distribuição eletrônica dos elementos de transição, podemos afirmar que seu subnível mais energético é o p.
E) O elemento químico sódio, de símbolo Na, encontra-se no grupo 18 (família 8A) da tabela periódica.
Resolução: Letra B
O item A está incorreto, pois o número atômico de um elemento químico corresponde à quantidade de prótons no núcleo do átomo.
O item B está correto, afinal um mesmo período da tabela periódica acomoda elementos que possuem igual número de camadas eletrônicas ocupadas.
O item C está incorreto. As colunas (verticais) da tabela periódica reúnem elementos com propriedades químicas bastante similares, por isso também podem ser chamadas de grupos ou famílias.
O item D está incorreto, pois os elementos de transição têm até o nível d ocupado por elétrons. O subnível d é mais energético do que o subnível p.
O item E está incorreto. O elemento químico sódio, de símbolo Na, encontra-se no grupo 1 da tabela periódica e pertence à família dos metais alcalinos.
Questão 2
(CESPE-UnB 2016 — adaptada)
No que se refere a raio atômico, assinale a opção correta.
a) Ao longo da tabela periódica, é notável a inter-relação entre a carga nuclear efetiva e o raio atômico dos elementos.
b) Quanto maior o raio atômico, maior é a energia de ionização.
c) Ao longo da tabela periódica, quanto maior for o raio atômico, maior será a afinidade eletrônica.
d) O raio de um ânion de um átomo é menor que o raio desse átomo em seu estado fundamental.
e) A contração lantanídica reduz o raio atômico e a energia de ionização de elementos lantanídeos, tornando metais como o ósmio e irídio altamente reativos.
Resolução: Letra A
O raio atômico é uma das propriedades periódicas e cresce dentro de um grupo no sentido de cima para baixo, pois o maior número de camadas aumentará o raio do átomo. Dentro dos períodos, o raio atômico diminui da esquerda para a direita, pois nesse sentido o número atômico (Z) aumenta. O aumento de Z indica maior quantidade de prótons no núcleo, logo os elétrons são atraídos mais intensamente pelo núcleo, e isso promove uma “contração” da eletrosfera, fazendo o átomo reduzir o seu raio. O efeito atrativo entre o núcleo positivo e os elétrons é a carga nuclear efetiva, propriedade que está relacionada com o raio atômico. Portanto, item A está correto.
O item B está incorreto, porque o quanto maior for o raio atômico, menor será a energia de ionização.
O item C está incorreto. Quanto maior for o raio atômico, menor será a afinidade eletrônica, pois menor será a energia liberada pelo átomo ao receber um elétron em uma camada mais distante do núcleo.
O item D está incorreto. Ânions são íons negativos, formados pela recepção de um elétron adicional. A entrada de um ânion aumenta o tamanho da eletrosfera. Logo, o raio iônico do íon é maior do que o raio do átomo em seu estado fundamental.
O item E está incorreto. A contração lantanídica ocorre com os lantanídeos e nada mais é do que o efeito de redução do raio em razão do efeito da carga nuclear efetiva. No entanto, as propriedades de raio atômico e energia de ionização são inversamente proporcionais.
Créditos da imagem
[1] Para visualizar a tabela em pdf, clique aqui.
[2] Mikhail Pogosov / Shutterstock
Artigos de Tabela periódica

Últimas notícias
Outras matérias


















