Cálculo da constante de equilíbrio

O cálculo da constante de equilíbrio envolve uma relação entre os participantes do produto e do reagente de uma reação química que se encontra em equilíbrio. Uma reação está em equilíbrio sempre que a velocidade da reação direta (para a direita) é igual à da reação inversa (para a esquerda).
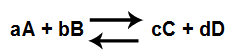
Equação genérica de uma reação química em equilíbrio
De uma forma geral, o cálculo da constante de equilíbrio químico pode ser realizado por meio das seguintes variáveis:
-
Concentrações em mol/L dos participantes;
→ Cálculo da constante de equilíbrio em termos de concentração em mol/L
A constante do equilíbrio pode ser calculada por meio das concentrações em mol/L, sendo chamada, por isso, de Kc. Para calcular o Kc, basta montar a expressão do equilíbrio e utilizar os valores das concentrações molares dos participantes, desde que elas estejam no equilíbrio.
Veja um exemplo:
Considere este equilíbrio:

Equação genérica de uma reação química em equilíbrio
A expressão do Kc deve apresentar a multiplicação das concentrações dos produtos (C, D) elevadas aos seus respectivos expoentes (c,d) e divididas pela multiplicação das concentrações dos reagentes (A,B) elevadas aos seus respectivos expoentes (a, b):
Kc = [C]c.[D]d
[A]a.[B]b
OBS.: Se alguns dos participantes estiver no estado sólido ou no estado líquido, jamais participará do cálculo do Kc.
Exemplo: (UNB) O pentacloreto de fósforo é um reagente muito importante em Química Orgânica. Ele é preparado em fase gasosa pela reação:
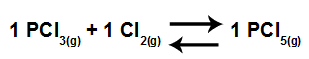
Um frasco de 3,00L contém as seguintes quantidades de equilíbrio, a 200ºC: 0,120mol de PCl5; 0,600mol de PCl3; e 0,0120mol de Cl2. Calcule o valor da constante de equilíbrio, em mol/L, a essa temperatura.
a) 20
b) 50
c) 75
d) 100
e) 125
Dados fornecidos pelo exercício:
-
número de mol do PCl5 = 0,120
-
número de mol do PCl3 = 0,600
-
número de mol do Cl2 = 0,0120
1o Passo: Determinar a concentração em mol/L de cada um dos participantes pela divisão do número de mol pelo volume fornecido.
-
PCl5 = 0,120 = 0,04 molL
3 -
PCl3 = 0,600 = 0,2 mol/L
3 -
Cl2 = 0,0120 = 0,004 mol/L
3
2o Passo: Montar a expressão do Kc:
Kc = [PCl5]1
[PCl3]1.[Cl2]1
3o Passo: Utilizar os valores encontrados na expressão do Kc:
Kc = [PCl5]1
[PCl3]1.[Cl2]1
Kc = (0,04)1
(0,2)1.(0,004)1
Kc = 0,04
0,2.0,004
Kc = 0,04
0,2.0,004
Kc = 0,04
0,0008
Kc= 50 mol/L-1
→ Cálculo da constante de equilíbrio em termos de concentração em mol/L, mas envolvendo o grau de equilíbrio (α).
O grau de equilíbrio (α) pode ser utilizado para realizar o cálculo da constante de equilíbrio. Esse grau é determinante para encontrar os valores das concentrações em mol/L existentes no equilíbrio.
Assim, se utilizamos 2 mol de um reagente da reação e o grau de equilíbrio é igual a 50%, temos que 1 mol foi convertido em produto, logo, no equilíbrio, há apenas a presença de 1 mol desse reagente.
Exemplo: (ENQ-RJ) Aqueceram-se 2 mol de pentacloreto de fósforo gasoso, PCl5, em um recipiente fechado, com capacidade de 2L. Atingido o equilíbrio, o PCl5 estava 40% dissociado em PCl3 e Cl2. Qual será o valor da constante de equilíbrio da reação?

Dados fornecidos pelo exercício:
-
número de mol inicial do PCl5 = 2;
-
Volume do recipiente = 2 L;
-
grau do equilíbrio (α) = 40%.
1o Passo: Determinar a concentração em mol/L do PCl5 que foi adicionada ao recipiente por meio da divisão do número de mol pelo volume fornecido.
-
PCl5 = 2 = 1 mol/L
2
2o Passo: Determinar as concentrações de todos os participantes no equilíbrio:
-
Como foi adicionado 1 mol/L de PCl5 e apenas 40% dele se dissociou, então, foram dissociados dele 0,4 mol/L, resultante da multiplicação entre 1 mol/L e 40%;
-
A proporção de todos os participantes é 1:1:1, por isso, temos 0,4 mol/L de PCl3 e 0,4 mol/L de Cl2 no equilíbrio;
-
Como foi adicionado 1 mol/L de PCl5 e apenas 0,4 mol/L dele se dissociou, logo, no equilíbrio, temos 0,6 mol/L dele (resultante do cálculo 1- 0,4).
3o Passo: Determinar a expressão do Kc
Kc = [PCl3]1.[Cl2]1
[PCl5]1
4o Passo: Utilizar os valores encontrados na expressão do Kc.
Kc = [PCl3]1.[Cl2]1
[PCl5]1
Kc = (0,4)1.(0,4)1
(0,6)1
Kc = 0,4.0,4
0,6
Kc = 0,16
0,6
Kc = 0,266 mol/L-1
→ Cálculo da constante de equilíbrio em termos de pressão
A constante do equilíbrio pode ser calculada por meio das pressões parciais dos participantes, sendo chamada, por isso, de Kp. Para calcular o Kp, basta montar a expressão do equilíbrio e utilizar os valores das pressões dos participantes, desde que elas estejam no equilíbrio.
Veja um exemplo:
Considere este equilíbrio:

Equação genérica de uma reação química em equilíbrio
A expressão do Kp deve apresentar a multiplicação das pressões parciais dos produtos (C, D) elevadas aos seus respectivos expoentes (c,d) e divididas pela multiplicação das pressões parciais dos reagentes (A,B) elevadas aos seus respectivos expoentes (a, b):
Kc = (pC)c. (pD)d
(pA)a. (pB)b
OBS.: Na expressão do Kp só participam produtos ou reagentes que estejam no estado gasoso.
Exemplo: (UFES) Em uma dada temperatura, as pressões parciais de cada componente da reação:
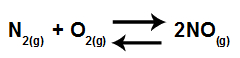
No equilíbrio valem, respectivamente, 0,8 atm, 2 atm e 1 atm. Qual é o valor de Kp?
a) 1,6
b) 2,65
c) 0,8
d) 0,0625
e) 0,625
Dados fornecidos pelo exercício:
-
pressão parcial do NO = 1 atm;
-
número de mol do N2= 0,8 atm;
-
número de mol do O2 = 2 atm.
1o Passo: Montar expressão do Kp.
Kp = (pNO)2
(pN2)1.(pO2)1
2o Passo: Utilizar os valores encontrados na expressão do Kp.
Kp = (pNO)2
(pN2)1.(pO2)1
Kp = (1)2
(0,8)1.(2)1
Kp = 1
0,8.2
Kp = 1
1,6
Kp = 0,625
→ Relação entre as constantes de equilíbrio em termos de concentração e pressão
Podemos ainda calcular a constante de equilíbrio em termos de concentração ou em termos de pressão por meio de uma única fórmula, a qual está representada abaixo:
Kp = Kc.(R.T)Δn
-
Kc = contante do equilíbrio em termos de concentração em mol/L;
-
Kp = contante do equilíbrio em termos de pressão;
-
R= constante geral dos gases (vale 0,082 para pressões em atm);
-
T = temperatura na escala Kelvin;
-
∆n = subtração entre os coeficientes dos produtos pelos coeficientes dos reagentes.
Exemplo: (Unimep) O valor do Kp para o equilíbrio:
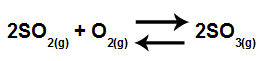
é de 2,8.102 à 103 K. O valor do Kc nessa temperatura será aproximadamente igual a :
a) 5,6.105
b) 2,8.106
c) 3,6.103
d) 8,2.102
e) 2,3.104
Dados fornecidos pelo exercício:
-
Temperatura = 103 K;
-
Kp = 2,8.102.
OBS.: R é igual a 0,082
1o Passo: Determinar o valor do ∆n pela subtração do coeficiente do produto pela soma dos coeficientes dos reagentes.
Δn = 2 - (2 + 1)
Δn = 2 – 3
Δn = -1
2o Passo: Utilizar os valores fornecidos e encontrados na expressão do Kp abaixo:
Kp = Kc.(R.T)Δn
2,8.102 = Kc. (0,082.103)-1
2,5.102 = Kc.(82)-1
2,8.102 = Kc
82
2,8.102.82 = Kc
Kc = 229,6.102
ou
Kc = 2,3.104
Artigos Relacionados

Últimas notícias
Outras matérias


















