Cetonas

As cetonas compõem uma função orgânica oxigenada, cujo grupo funcional é uma carbonila (um carbono que faz uma dupla ligação com um oxigênio). Nas cetonas, a carbonila deve estar entre outros dois átomos de carbono, nunca podendo estar na ponta da cadeia. Toda cetona deve possuir o sufixo -ona em seu nome oficial, conforme recomenda a Iupac.
Na indústria e nos laboratórios, as cetonas são importantes solventes e precursores para compostos mais complexos. Além disso, muitas cetonas possuem fragrâncias agradáveis e, por isso, podem também ser utilizadas na fabricação de perfumes e demais cosméticos.As cetonas podem ser obtidas principalmente por reações de oxidação de álcoois secundários e alcenos.
Leia também: Álcoois — outra função orgânica oxigenada
Resumo sobre cetonas
-
As cetonas possuem o grupo carbonila como grupo funcional.
-
A carbonila das cetonas deve estar ligada a outros átomos de carbono, não podendo estar na extremidade da cadeia.
-
As cetonas podem ser tanto de cadeia aberta quanto de cadeia fechada.
-
Toda cetona possui sufixo -ona em sua nomenclatura oficial.
-
O grupo carbonila aumenta o caráter polar das cetonas.
-
A propanona, vendida como acetona, é amplamente utilizada com solvente e removedora de tinta e esmalte.
-
As cetonas podem ser utilizadas na fabricação de perfumes e demais cosméticos devido a sua fragrância agradável.
Videoaula sobre cetonas
Estrutura das cetonas
Toda cetona possui o grupo carbonila, em que um átomo de carbono faz uma ligação dupla com um átomo de oxigênio. As outras duas ligações do carbono ficam disponíveis para se ligarem com outros átomos quaisquer. No caso específico das cetonas, essas duas outras ligações são obrigatoriamente com outros átomos de carbono. As cetonas podem ser tanto de cadeia aberta quanto de cadeia fechada.
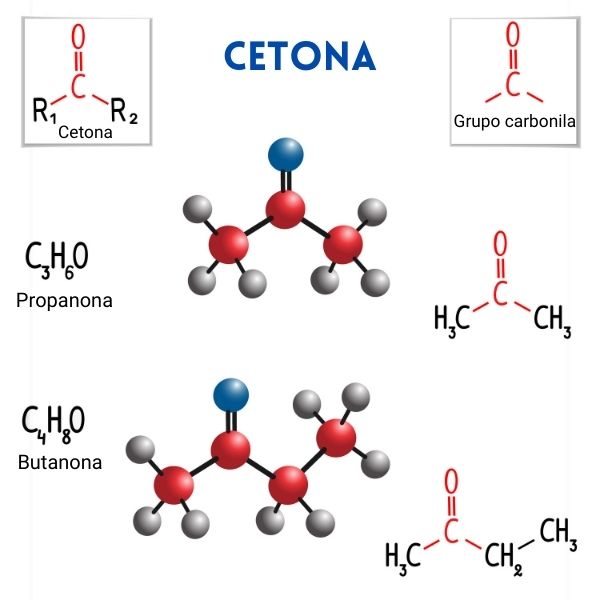
Nomenclatura das cetonas
A União Internacional de Química Pura e Aplicada (Iupac) regulamenta a nomenclatura oficial das cetonas assim como de todos os outros compostos químicos. Além das regras tradicionais de nomenclatura orgânica, as cetonas devem sempre ter o sufixo -ona. Outro ponto importante é que o grupo carbonila pode adotar posições diferentes com base em cetonas de cadeia aberta com cinco carbonos e, por isso, deve ter sua posição indicada na nomenclatura do composto.
Exemplos:
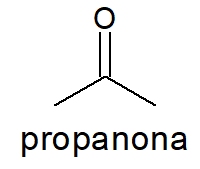
-
Prefixo prop-, por só possuir três carbonos na cadeia principal.
-
Infixo -an-, por apenas possuir ligações simples entre carbonos.
-
Não há necessidade de indicar a posição da carbonila, pois isso é redundante.
-
Sufixo -ona, por se tratar de uma cetona.
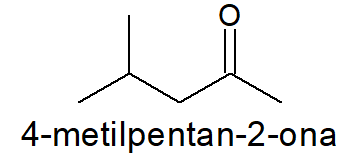
-
Metil na posição 4, pois o grupo funcional tem prioridade, sendo assim, o carbono de número 1 é o carbono de extremidade mais próximo à carbonila.
-
Prefixo pent-, pois a cadeia principal possui cinco carbonos.
-
Infixo -an-, por apenas possuir ligações simples entre carbonos.
-
A carbonila está no carbono de número 2, devendo essa posição ser indicada no nome oficial.
-
Sufixo -ona, por se tratar de uma cetona.
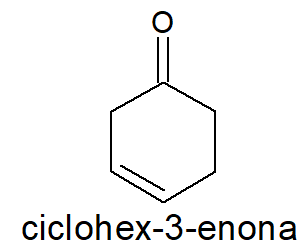
-
Prefixo ciclohex-, por se tratar de uma cadeia fechada de seis carbonos.
-
Prefixo -en-, por conta da presença de uma ligação dupla entre carbonos.
-
A ligação dupla fica na posição 3, pois o grupo carbonila possui prioridade, sendo, nesse caso, o carbono de número 1.
-
Sufixo -ona, por se tratar de uma cetona.
-
A posição da carbonila não deve constar no nome oficial, pois isso seria redundante.
Leia também: Nomenclatura usual de cetonas — aquela que tem como base os radicais orgânicos ligados à carbonila
Propriedades das cetonas
O grupo carbonila é polar, o que permite interações intermoleculares do tipo dipolo-dipolo, fazendo com que possuam um ponto de fusão e um ponto de ebulição mais alto que dos hidrocarbonetos de tamanho semelhante. Contudo, moléculas de cetona não podem fazer ligações de hidrogênio entre elas e, por isso, álcoois de tamanho semelhante possuem pontos de fusão e ebulição maiores.
Do ponto de vista de solubilidade, o caráter polar da carbonila permite a solubilidade de cetonas em outros solventes polares, como é o caso da água. Além disso, cetonas podem fazer ligações de hidrogênio com moléculas de água, o que se torna mais um fator para aumentar a solubilidade desses compostos nessa substância. Porém, conforme a cadeia vai aumentando, o caráter apolar das cadeias carbônicas vai se tornando mais significativo, diminuindo a solubilidade desses compostos em solventes polares.
|
Cetona |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
Solubilidade em água |
|
Propanona |
-95 |
56,1 |
Completamente solúvel |
|
Butanona |
-86 |
79,6 |
290 g/L |
|
Pentan-2-ona |
-78 |
102 |
40 g/L |
|
Acetofenona |
20 |
202 |
5,5 g/L |
|
Benzofenona |
48,5 |
305 |
Insolúvel |
Aplicação das cetonas
A cetona de maior utilização comercial é a propanona, sendo seu nome comercial, acetona, de amplo conhecimento. É utilizada como solvente de esmaltes, tintas e vernizes, e também para a extração de óleos de sementes vegetais.
As cetonas também podem ter fragrâncias agradáveis e, por conta disso, podem ser utilizadas na fabricação de cosméticos e perfumes. Originalmente, os perfumes tinham em sua composição os óleos essenciais naturais, os quais podem, inclusive, ser cetonas, como é o caso da carvona.
Contudo, nos dias atuais, o avanço das técnicas permite o desenvolvimento de fragrâncias sintéticas, resultadas da arte e criatividade dos químicos. A Z-jasmona (fragrância de jasmin) e a ɑ-damascona (fragrância de rosas) são exemplos de cetonas obtidas de fontes naturais e utilizadas na confecção de perfumes.
As cetonas também estão no centro das dietas cetogênicas. Nessa modalidade de dieta — indicada para controle da epilepsia e convulsões assim como para o tratamento de obesidade, diabetes tipo 2 e até alguns tipos de câncer —, o corpo produz energia da gordura, e não da glicose, como estamos acostumados.
Nesse tipo de dieta, ocorre a chamada cetogênese, que é a síntese de corpos cetônicos por meio da transformação dos lipídeos em glicose, com base em um excesso de acetil-CoA. O excesso de acetil-CoA é consequência da lipólise, a qual ocorre por conta de baixa glicemia no corpo, causada pelas características da dieta cetogênica ou também por períodos de longo jejum.
Entre os corpos cetônicos produzidos, está o ácido acetoacético, uma cadeia mista que possui os grupos cetona e ácido carboxílico, o qual será utilizado como fonte de energia.
Uma característica interessante que indica que a pessoa está em cetose (condição em que há aumento anormal da concentração dos corpos cetônicos) é o hálito, o qual passa a ter um odor semelhante à propanona.
Leia também: Amidas — função nitrogenada que apresenta uma carbonila ligada a um nitrogênio
Síntese e formas de obtenção de cetonas
As cetonas podem ser obtidas por meio de reações de oxidação de alcenos ou de álcoois. No caso dos alcenos, a produção de cetonas se dá por ozonólise ou oxidação enérgica, enquanto, para álcoois, apenas álcoois secundários as produzem ao serem oxidados.
-
Ozonólise: processo redox em que a ligação dupla do alceno é clivada por ação do ozônio. Para que a cetona seja o produto resultante, o carbono da ligação dupla deve ser ramificado.
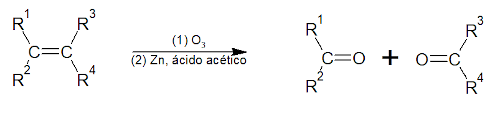
Nesse exemplo, as letras R indicam cadeias carbônicas quaisquer.
-
Oxidação energética: processo de oxirredução em que átomos de oxigênio são adicionados aos carbonos da dupla. Para que sejam produzidas cetonas, os carbonos da dupla ligação devem ser ramificados.
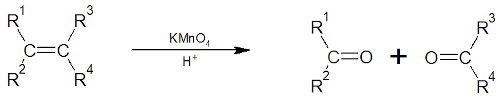
Nesse exemplo, as letras R indicam cadeias carbônicas quaisquer.
-
Oxidação de álcoois secundários: segue por um mecanismo de eliminação (chamado de E2). O agente oxidante pode ser tanto o ácido crômico (H2Cr2O4) quanto o clorocromato de piridínio (PCC).
Nesse exemplo, as letras R indicam cadeias carbônicas quaisquer.
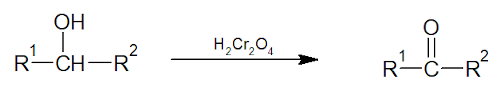
Diferença entre cetonas e aldeídos
Aldeídos e cetonas são as duas funções orgânicas com a presença do grupo carbonila. Além de serem isômeros de função, possuem aplicações práticas muito semelhantes (aldeídos também podem ser usados na fabricação de perfumes, por exemplo), o que leva à confusão entre as duas funções. A principal diferença entre um aldeído e uma cetona é a posição da carbonila.
Enquanto, nas cetonas, a carbonila está entre dois átomos de carbono, a carbonila da função aldeído deve ficar na extremidade da cadeia, na qual, além do oxigênio, o carbono do grupo carbonila deve também possuir um hidrogênio ligado a ele.
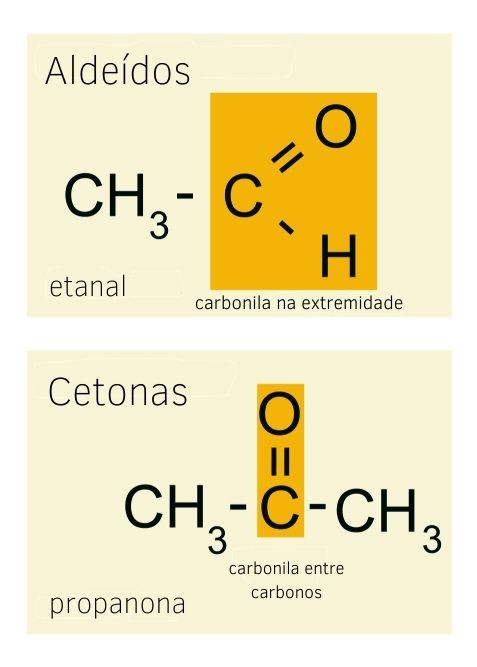
Por serem de funções diferentes, os sufixos também são diferentes. Enquanto cetonas terminam com -ona, os aldeídos terminam seu nome com o sufixo -al.
Leia também: Principais aldeídos presentes no cotidiano
Exercícios resolvidos sobre cetonas
Questão 1
(Uerj) Observe as seguintes estruturas de quatro vitaminas lipossolúveis:
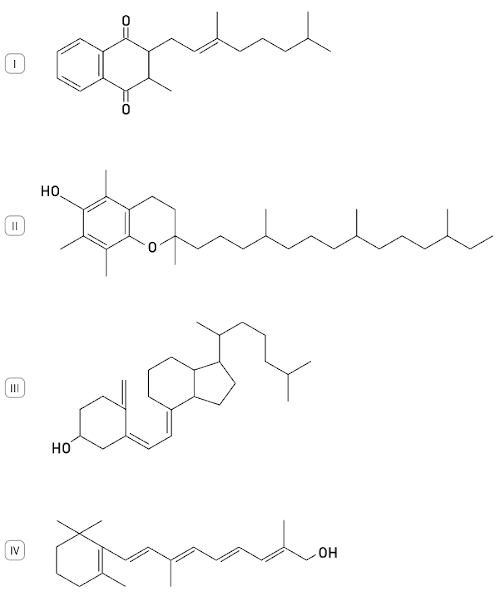
As vitaminas A e D apresentam a função álcool em suas estruturas, a vitamina E apresenta a função fenol, e a vitamina K, a função cetona.
Para manutenção das propriedades de coagulação do sangue, é necessária a absorção da
vitamina representada pela estrutura de número:
(A) I
(B) II
(C) III
(D) IV
Resposta: Letra A
A vitamina responsável pela coagulação do sangue é a vitamina K. O texto deixa claro que a vitamina K é a que possui a função cetona.
Entre todas as vitaminas, a única que possui a função cetona (grupo carbonila entre átomos de carbono) é a de número I.
Questão 2
(UFG) No início da glicólise, a glicose na forma cíclica é fosforilada. A seguir, uma enzima promove a abertura do anel e uma transformação de grupo funcional, seguida de fechamento de anel, produzindo a frutose-6-fosfato. A sequência de transformação dos grupos funcionais está apresentada a seguir.
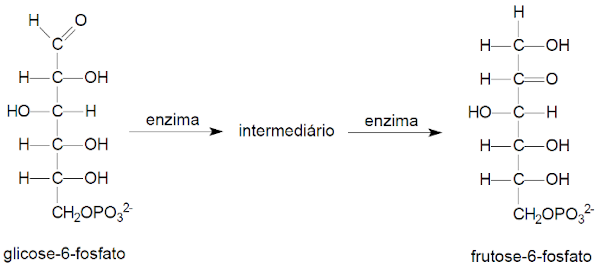
Nesse sentido, conclui-se que a transformação de um dos grupos funcionais envolve a conversão de
(A) um álcool em éter.
(B) um álcool em cetona.
(C) um aldeído em éter.
(D) um aldeído em cetona.
(E) uma cetona em éter.
Resposta: Letra B
Ao observar-se as estruturas, percebe-se que dois carbonos sofreram transformação dos grupos funcionais. O primeiro (de cima para baixo) passa da função aldeído (repare que a carbonila possui um átomo de hidrogênio ligado ao átomo de carbono) para função álcool.
O carbono seguinte, logo abaixo, é originalmente da função álcool. Porém, ao fim do processo, esse carbono termina como função cetona (a carbonila está entre dois átomos de carbono).
Assim, deve-se marcar uma opção que contenha a transformação do aldeído em álcool ou do álcool em cetona, o que se observa na letra B, uma vez que nenhuma alternativa mencionou a transformação de aldeído para álcool.
Artigos Relacionados

Últimas notícias
Outras matérias


















