Corrosão dos metais

“Corrosão” é um termo que geralmente é empregado para se referir à destruição gradativa dos metais. Na realidade, porém, esse termo é bem mais amplo, pois existem três tipos de corrosões (química, eletroquímica e eletrolítica), que podem ou não ocorrer com metais, ocorrendo também com concreto e com polímeros, por exemplo. Mas a que iremos tratar aqui é a corrosão eletroquímica.
Essa corrosão envolve reações de oxidorredução que transformam os metais em óxidos ou em outros compostos. Por exemplo, como as imagens abaixo mostram, vemos no cotidiano a formação de ferrugem em objetos de ferro, a prata ficar mais escura com o tempo e a formação de uma camada verde, mais conhecida como azinhavre, sobre objetos feitos de cobre.

Em todos esses casos ocorreu que o metal oxidou-se, isto é, perdeu elétrons, enquanto outra espécie química, como o oxigênio (O2) do ar, sofreu redução (ganhou os elétrons), causando a oxidação do metal.
Todos os metais sofrem corrosão, com exceção apenas do ouro e da platina. No entanto, no caso de alguns metais, essa corrosão é menos violenta porque os compostos formados funcionam como uma espécie de proteção. Por exemplo, no caso da prata mencionada, a película preta que acaba servindo como proteção é o sulfeto de prata (Ag2S), que se forma em contato com o oxigênio do ar e com a poluição atmosférica (que envolve compostos do enxofre):
4Ag(s) + O2(g) + 2S2-(aq) + 4H+(aq) → 2Ag2S(s) +2H2O(?)
Essa camada insolúvel de sulfeto de prata tem coloração azulada ou ligeiramente violácea e, com o tempo, vai ficando preta.
No caso do cobre, o azinhavre formado é, na verdade, uma mistura tóxica de hidróxido de cobre I, hidróxido de cobre II, carbonato de cobre I e carbonato de cobre II.
A corrosão dos metais é um processo que ocorre espontaneamente e causa anualmente grandes prejuízos econômicos para nossa sociedade. Objetos metálicos nos lares são perdidos, tais como utensílios e eletrodomésticos; nas indústrias, equipamentos e máquinas industriais precisam receber manutenção ou ser substituídos; há o risco de vazamentos de materiais poluentes para o meio ambiente em virtude da corrosão de tubulações e tanques, além de poder também ocorrer acidentes. Nas cidades, ocorre a corrosão de estruturas de pontes, edifícios, carros, navios e monumentos artísticos.
Calcula-se que 30% de todo o aço (liga metálica feita de aproximadamente 98,5% de ferro, 0,5% a 17% de carbono e traços de silício, enxofre e fósforo) mundial seja produzido apenas para repor objetos que foram corroídos.

Isso nos mostra que o maior prejuízo e a mais conhecida corrosão é a que ocorre com o ferro, formando a ferrugem. Mas como ela ocorre e de que é constituída a ferrugem?
O mecanismo completo da corrosão do ferro ainda não está completamente esclarecido, mas sabe-se que ela está relacionada à oxidação do ferro por meio de agentes oxidantes, que são a água e o oxigênio. Por isso, o ferro oxida-se facilmente quando é exposto ao ar úmido, principalmente se houver grande presença de água.
Bem, visto que o ferro possui potencial de oxidação maior que o do oxigênio, ele perde elétrons, ocorrendo a seguinte reação anódica:
Fe (s) → Fe2+ + 2 e-
Existem vários processos de redução que podem ocorrer, mas o da água é o mais significativo:
2 H2O + 2e– → H2 + 2OH–
Para que ocorra esse processo de oxirredução, deve haver contato elétrico entre a região anódica e catódica para que ocorra o fluxo de íons entre essas regiões e o circuito elétrico feche-se. Isso acontece como mostra a figura a seguir:
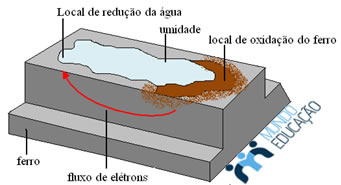
Os íons Fe2+ têm a tendência de migrar para a região catódica (polo negativo), enquanto os ânions OH- migram para o polo positivo (região catódica), ocorrendo a formação do hidróxido ferroso (Fe(OH)2).
Fe2+ + 2OH– → Fe(OH)2
Na presença de oxigênio, esse composto é oxidado a hidróxido de ferro III (Fe(OH)3), que depois perde água e transforma-se no óxido de ferro (III) mono-hidratado (Fe2O3 . H2O), que é um composto que possui coloração castanho-avermelhada, isto é, a ferrugem que conhecemos:
2Fe(OH)2 + H2O + 1/2O2 → 2 Fe(OH)3
2Fe(OH)3 → Fe2O3 . H2O + 2H2O
A presença da água favorece a formação da ferrugem porque possui íons dissolvidos, o que facilita o fluxo dos elétrons.
Apesar de tais perdas, os cientistas pesquisam constantemente várias técnicas que conseguem evitar essas corrosões, tais como o uso de pinturas protetoras, a produção de aço inoxidável e o uso de metais de sacrifício em técnicas conhecidas como galvanoplastia e galvanização.
Artigos Relacionados

Últimas notícias
Outras matérias


















