Densidade

Densidade é uma propriedade física que relaciona a massa de um material ao volume que ele ocupa, sendo característica de cada substância. Medidas de densidade são afetadas por alterações de pressão, temperatura e composição química.
A densidade é empregada em procedimentos de controle de qualidade, como análise de leite, combustíveis e bebidas alcoólicas. Por meio dos valores de densidade, também é possível determinar se uma substância afunda ou se mantém suspensa em outra.
Saiba mais: Qual a relação entre peso e massa?
Resumo sobre densidade
-
Densidade é uma propriedade física de elementos químicos e substâncias.
-
A densidade é determinada pela relação massa/volume.
-
Pelo S.I., a densidade possui unidades de kg/cm3, mas é comumente expressa em termos de g/mL ou g/L.
-
A densidade de misturas é determinada pela média ponderada, considerando a proporção da mistura e a densidade de cada substância pura.
-
A composição química afeta as medidas de densidade.
-
A temperatura afeta as medidas de densidade. Quanto maior a temperatura, menor a densidade.
-
A variação de pressão em sistemas gasosos afeta as medidas de densidade, pois altera o volume ocupado pelo gás.
-
Na Tabela Periódica, a densidade aumenta de cima para baixo e das extremidades para o centro.
O que é densidade?
Densidade é uma propriedade específica da matéria que associa a massa de um material ao volume que ele ocupa. É considerada uma propriedade intensiva, pois a densidade é a mesma, independentemente da porção de massa analisada, desde que se mantenham as condições ambientais (temperatura e pressão).
As substâncias possuem valores de densidade específicos, sendo essa propriedade uma ferramenta de caracterização de materiais. Por isso, medidas de densidade são empregadas em análises de controle de qualidade de bebidas e de combustíveis, por exemplo.
Conhecer os valores de densidade também é importante para determinar se um objeto vai flutuar ou afundar em um determinado meio. No mar Morto, um grande lago situado no Oriente Médio, a quantidade de sais presentes na água é cerca de dez vezes maior do que a concentração salina nos oceanos. Essa característica torna a água do mar Morto bastante densa, sendo muito fácil a tarefa de flutuar na água.
A densidade é diretamente proporcional à força peso, por isso objetos e substâncias de maior densidade se localizam na região mais baixa do recipiente em que estão.
Interessante: O conceito de densidade pode ser empregado em outras áreas além da Química. Por exemplo, na Matemática é investigada a densidade de objetos, e na área de Geografia, o termo densidade pode ser associado ao conceito de densidade demográfica.
Como se calcula a densidade?
A densidade de um corpo ou de uma substância é dada pela divisão matemática entre a sua massa e o volume ocupado por ela, mas isso leva alguns aspectos em consideração de acordo com o tipo de corpo ou substância.
→ Densidade de substâncias puras
Para uma substância pura, a densidade é calculada pela divisão matemática entre massa e volume do material analisado:
\(\mathbf{densidade}=\ \frac{\mathbf{massa}}{\mathbf{volume}}\)
É comum encontrar densidade simbolizada pela letra grega rô (\(\mathbf{\rho}\)).
→ Densidade de soluções
Para a determinação de densidade de soluções ― que são misturas homogêneas ―, a densidade é calculada por meio da média ponderada, considerando as densidades de cada substância pura e a sua quantidade relativa na mistura.
\(\mathbf{densidade}=\ \frac{{(\mathbf{densidade}}_\mathbf{1}.\ \ \mathbf{x}_\mathbf{1})\ .\ \ ({\mathbf{densidade}}_\mathbf{2}.\ \ \mathbf{x}_\mathbf{2})}{\mathbf{volume}\ \mathbf{total}}\)
Em que x1 e x2 são as proporções de cada componente da mistura.
Essa abordagem é utilizada para monitorar a qualidade do leite e dos combustíveis, por exemplo, que podem ser adulterados pela adição de água ou de outras substâncias mais pesadas.
Quando é adicionado algum tipo de soluto a um solvente, também ocorre alteração da densidade. Para calculá-la, deve-se considerar a massa do soluto adicionada e a massa do solvente e dividir pelo volume:
\(\mathbf{densidade}=\ \frac{{\mathbf{massa}}_{\mathbf{solvente}}+\ \ {\mathbf{massa}}_{\mathbf{soluto}}}{\mathbf{1}\ \mathbf{L}}\)
-
Exemplo
O álcool mais eficiente para a desinfecção de mãos e superfícies é o álcool 70 INPM. O termo INPM é um tipo de unidade de medida empregada pelo Instituto de Pesos e Medidas e indica a massa de álcool que foi diluída em cada litro de água.
Portanto, na preparação do álcool 70, foram empregados 700 mL de álcool para cada 1 litro de água. Em termos percentuais, nessa mistura existem 70% de álcool e 30% de água.
Para calcular a densidade dessa mistura, considera-se o valor de densidade de cada substância pura e as respectivas composições:
\(\mathbf{densidade}=\frac{\ \mathbf{(densidade_{etanol}\cdot 70)}+ \mathbf{(densidade_{água}. 30)}}{1 L}\)
Leia também: Adulteração da gasolina e suas consequências
Qual a unidade de medida de densidade?
Considerando o Sistema Internacional (S.I.), a unidade utilizada para medir massa é quilogramas (kg), e a unidade oficial para expressar volume é metros cúbicos (m3). Logo, no S.I., a densidade deve ser expressa em termos de kg/m3 (quilogramas por metro cúbico).
No entanto, é recorrente encontrar outras unidades para expressar relações de densidade, como:
-
kg/L (quilogramas por litro);
-
g/mL (gramas por mililitro);
-
g/m3 (gramas por metro cúbico).
Essas unidades podem ser convertidas às unidades padrão S.I. aplicando as relações de equivalência:
\({\mathbf{1}\ \mathbf{m}}^\mathbf{3}=\mathbf{1000}\ \mathbf{L}\)
\(\mathbf{1}\ \mathbf{L}=\mathbf{1000}\ \mathbf{mL}\)
\(\mathbf{1}\ \mathbf{kg}=\mathbf{1000}\ \mathbf{g}\)
Quais são os fatores que afetam a densidade?
Como a densidade é determinada em função da massa e do volume de substâncias, ela é afetada por alguns fatores. Veja a seguir.
→ Alteração de composição química
Cada substância pura possui uma única medida de massa para um determinado volume ― a uma mesma temperatura e pressão ―, sendo a densidade empregada como uma forma de identificação substâncias diferentes.
Ao alterar a composição química pela adição de um soluto ou de outra substância, a densidade resultante será diferente, devendo ser determinada pelas relações matemáticas específicas que vimos acima.
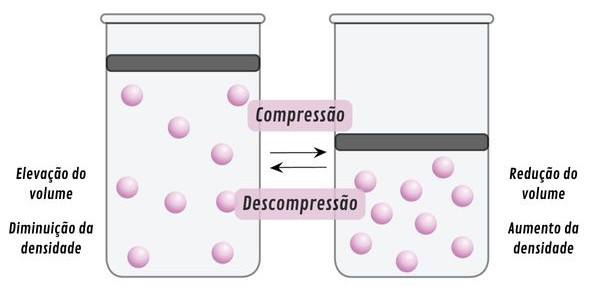
→ Alteração de pressão
Alterações de pressão causam variação de densidade, especialmente para substâncias gasosas, que possuem característica expansível. Afinal, os gases preenchem completamente o espaço que os contém, tomando a forma e o volume do recipiente em que estão contidos.
Assim, ao aumentar a pressão sobre um sistema, o gás será comprimido, e seu volume, diminuído. O efeito será a elevação de densidade. De modo oposto, quando um sistema é despressurizado (redução da pressão), o gás se expande até ocupar todo o volume disponível, de modo a diminuir a sua densidade.
→ Alteração de temperatura
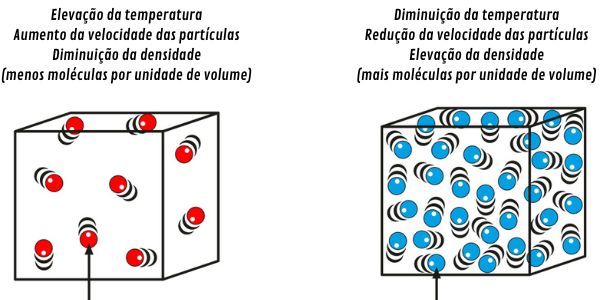
O efeito da temperatura sobre a densidade está associado ao grau de movimentação das partículas e sua energia cinética. Ao elevar a temperatura de um sistema, suas partículas têm a energia cinética aumentada e passam a se movimentar com maior velocidade, aumentando o distanciamento entre elas.
Esse comportamento leva à diminuição da densidade em razão do natural aumento de volume. Ao promover o resfriamento de um sistema, as partículas têm sua energia cinética diminuída e a velocidade de movimentação reduzida, implicando na aproximação entre elas e na diminuição do volume ocupado. Portanto, o efeito de redução da temperatura implica em elevação da densidade.
-
Comportamento irregular da água
A água apresenta uma peculiaridade em termos de densidade. Ela tem sua densidade aumentada com o efeito de resfriamento até a temperatura de 4 °C. Abaixo disso, a densidade da água volta a diminuir, em um comportamento totalmente diferente das demais substâncias.
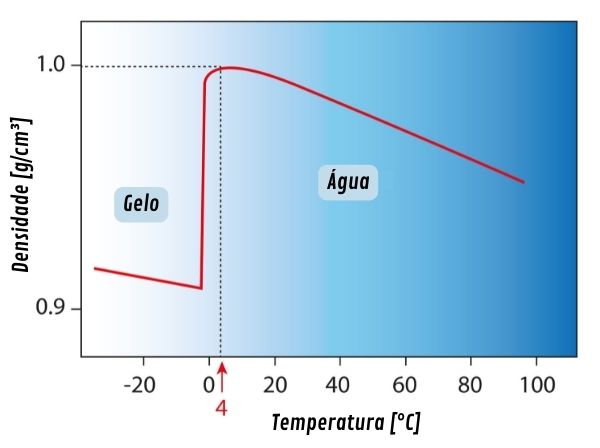
O que ocorre nesse caso em particular é que a água sofre uma expansão ao invés de compressão abaixo do limite de 4 °C. Em baixa temperatura, a água tem o movimento de agitação molecular reduzido, e suas moléculas se agrupam em formatos cristalinos.
Os cristais formados ocupam um volume maior em comparação ao volume que seria ocupado pelas moléculas isoladas. Por isso, a água em estado sólido (gelo) e em temperatura entre 0 e 4 °C possui maior valor de densidade em comparação com a água líquida.
Esse comportamento característico da água é fundamental para a manutenção da vida aquática nos períodos mais frios. Quando a temperatura ambiente começa a cair com a chegada do inverno, a água dos lagos começa a resfriar.
Como a água em temperatura entre 0 e 4 °C é menos densa do que massas de água mais quentes, ela se mantém na superfície do lago e acaba congelando, por estar em contato com a atmosfera mais fria. Dessa forma, apenas a superfície do lago congela, e seu interior é mantido com água mais densa e em maiores temperaturas, possibilitando a manutenção da vida aquática.
Densidade dos materiais
Diferentes materiais podem ser comparados de acordo com seus valores de densidade. Considere amostras de 1 kg do metal chumbo e de 1 kg de algodão. Qual é mais pesado: 1kg de chumbo ou 1k de algodão?
É intuitivo imaginar que a amostra de chumbo seria “mais pesada”, mas note que ambas as amostras possuem a mesma massa ― 1 kg. Na realidade, quando fazemos essa comparação, devemos ter em mente os volumes ocupados pela amostra de 1 kg de chumbo e de 1 kg de algodão.

Como o algodão é menos denso que o chumbo, 1 kg de algodão ocupará um volume muito maior do que 1 kg de chumbo.
A tabela abaixo apresenta a densidade de alguns materiais.
|
Material |
Densidade / g cm-3 |
|
Água |
1,0 (4 °C) e 0,997 (25 °C) |
|
Leite |
1,03 |
|
Ar atmosférico |
0,00122 |
|
Gás hélio |
0,000178 |
|
Etanol |
0,789 |
|
Gasolina |
0,680 |
|
Ferro |
7,9 |
|
Ouro |
19,3 |
|
Chumbo |
11,34 |
|
Mercúrio |
13,6 |
|
Ósmio |
22,6 |
A densidade de líquidos, inclusive de misturas homogêneas, pode ser determinada facilmente com o uso de um equipamento chamado de densímetro. O densímetro é um tubo de vidro que contém uma escala numérica na parte superior e um bulbo com esferas de chumbo na parte inferior.
Ao mergulhar o densímetro na substância a ser analisada, o instrumento afunda mais profundamente quanto menor a densidade do líquido, registrando uma determinada leitura na escala numérica. Em líquidos de maior densidade, o densímetro mergulha em menor profundidade no líquido.

Em postos de combustível, é obrigatório ter acoplado às bombas equipamentos para fornecer informações sobre a densidade dos combustíveis, a fim de evitar adulterações.
Quais são os tipos de densidade?
→ Densidade absoluta
A densidade absoluta nada mais é do que a relação entre massa e volume de uma substância, sendo uma propriedade específica do material. Ou seja, cada substância pura possui seu próprio valor de densidade, que a caracteriza e a diferencia das demais.
→ Densidade relativa
A densidade relativa é empregada para realizar comparações com outra substância, tida como padrão.
A densidade relativa é determinada pela relação matemática entre a densidade absoluta de uma substância e a densidade absoluta de outra, considerada como padrão para aquela comparação.
\({\mathbf{Densidade}}_{\mathbf{relativa}}=\frac{\mathbf{ densidade_{absoluta}}} {\mathbf{densidade_{absoluta\ do\ ''padrão''}}}\)
Normalmente, a densidade da água pura é empregada como padrão para a determinação de densidades relativas de outras substâncias.
A densidade relativa pode ser utilizada para prever se uma substância afunda ou se mantém na superfície de um líquido. Quando empregada na comparação entre diferentes líquidos, permite identificar quais deles ficariam na parte superior e inferior do frasco.
-
Experimento com óleo de soja, água e areia
Veremos abaixo um experimento simples para comparar a densidade relativa do óleo de soja, da água e da areia. Veja suas densidades a seguir.
|
Substâncias |
Densidades absolutas / kg m-3 |
|
Água |
~1000 |
|
Óleo de soja |
~800 |
|
Areia |
~1500 |
Empregando a água como padrão, nesse estudo, a densidade relativa do óleo de soja em relação à água seria:
\({\mathbf{Densidade}}_{\mathbf{relativa}}=\ \frac{\mathbf{800}\ \mathbf{kg}\ \mathbf{m}^\mathbf{3}}{\mathbf{1000}\ \mathbf{kg}\ \mathbf{m}^\mathbf{3}}=\mathbf{0},\mathbf{8}\)
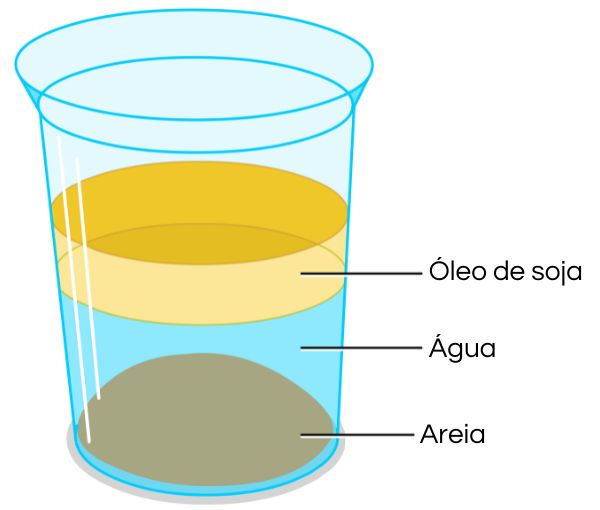
Esse resultado, sendo menor do que 1, indica que o óleo de soja é menos denso do que água e assume a parte superior em um frasco contendo as duas substâncias. Comparando água e areia, tem-se:
\({\mathbf{Densidade}}_{\mathbf{relativa}}=\ \frac{\mathbf{1500}\ \mathbf{kg}\ \mathbf{m}^\mathbf{3}}{\mathbf{1000}\ \mathbf{kg}\ \mathbf{m}^\mathbf{3}}=\mathbf{1},\mathbf{5}\)
Esse resultado, superior a 1, indica que a areia é mais densa do que a água e ocupará a parte do fundo de um frasco. É exatamente isso que é observado ao adicionar essas três substâncias ao mesmo frasco. Veja na ilustração:
Densidade x massa específica
Os conceitos de densidade e massa específica podem causar uma certa confusão, pois são expressos pela mesma relação matemática e pelas mesmas unidades de medida.
A massa específica é a relação entre a massa e o volume ocupado, assim como foi definida a densidade. No entanto, a massa específica é exclusiva para se referir a um material ou substância, enquanto a densidade é utilizada para se referir ao objeto ou ao corpo.
Por exemplo, considere duas esferas de cobre (\(\rho\) = 8,96 g/cm3), uma delas maciça e a outra porosa. Para a esfera maciça, a densidade e a massa específica possuirão o mesmo valor, igual a 8,96 g/cm3.
Para a esfera porosa, a massa específica continua sendo a mesma, mas a densidade da esfera será menor, uma vez que para um mesmo volume, a massa do corpo será mais baixa em razão das cavidades.
Para líquidos e gases, a densidade e a massa específica são iguais.
Densidade na tabela periódica
A densidade, sendo uma propriedade física dos materiais, é determinada de acordo com o elemento químico da substância e é uma das propriedades periódicas.
A densidade absoluta dos elementos químicos varia de forma previsível na Tabela Periódica:
-
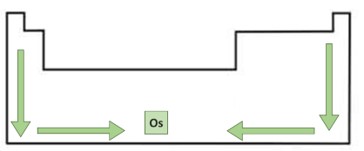
Dentro dos grupos, ou seja, nas colunas, a densidade aumenta de cima para baixo, em resposta ao maior número de camadas eletrônicas.
-
Dentro das linhas, conhecidas como períodos, a densidade aumenta das extremidades para o centro da Tabela Periódica.
Assim, os elementos na região central inferior da tabela são os que possuem densidade absoluta mais elevada. O ósmio é o elemento químico mais denso, registrando densidade igual a 22,5 g/cm3.
Saiba também: Propriedades periódicas e aperiódicas
Exercícios resolvidos sobre densidade
Questão 1
(Enem) Pelas normas vigentes, o litro do álcool hidratado que abastece os veículos deve ser constituído de 96% de álcool puro e 4% de água (em volume). As densidades desses componentes são dadas na tabela.
|
Substância |
Densidade (g/L) |
|
Água |
1000 |
|
Álcool |
800 |
Um técnico de um órgão de defesa do consumidor inspecionou cinco postos suspeitos de venderem álcool hidratado fora das normas. Colheu uma amostra do produto em cada posto e mediu a densidade de cada uma, obtendo:
|
Posto |
Densidade do combustível (g/L) |
|
I |
822 |
|
II |
820 |
|
III |
815 |
|
IV |
808 |
|
V |
805 |
Por meio desses dados, o técnico pôde concluir que estavam com o combustível adequado somente os postos
A) I e II.
B) I e III.
C) II e IV.
D) III e V.
E) IV e V.
Resolução:
Alternativa E
Inicialmente, deve ser calculada a densidade da mistura, considerando as densidades absolutas e a composição de 96% etanol e 4% água para o volume de 1 L.
\({densidade}=\frac{ (densidade_{etanol} . proporção_{etanol})+ (densidade_{água} . proporção_{água})}{1 L}\)
\({densidade}=\ \frac{({800}\ {g}/{L}\ .\ \ {0},{96})+({1000}\ {g}/{L}\ .\ {0},{04})}{{1}\ {L}}\)
\({densidade}={808}\frac{{g}}{{L}}\)
Ou seja, para seguir as normas vigentes, a densidade do álcool combustível deve ser de no máximo 808 g/L. Esse valor de densidade reflete, exatamente, a proporção 96% de etanol e 4% de água.
Valores superiores a 808 g/L indicam combustível adulterado pela adição de água, modificação que resulta em aumento da densidade, pois a água é mais densa do que o etanol.
Logo, apenas os postos IV e V estão com o etanol combustível adequado.
Questão 2
(UFPE) Para identificar três líquidos — de densidades 0,8,1,0 e 1,2 —, o analista dispõe de uma pequena bola de densidade 1,0. Conforme as posições das bolas apresentadas no desenho a seguir, podemos afirmar que
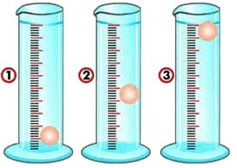
A) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 0,8, 1,0 e 1,2.
B) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 0,8 e 1,0.
C) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 0,8 e 1,2.
D) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,2, 1,0 e 0,8.
E) os líquidos contidos nas provetas 1, 2 e 3 apresentam densidades 1,0, 1,2 e 0,8.
Resolução:
Alternativa A
Como a bola possui densidade igual a 1, é possível resolver a questão considerando a densidade relativa entre o líquido de cada uma das provetas e a bola, de densidade conhecida.
\({{Densidade}}_{{relativa}}=\frac{ densidade_{líquido}}{densidade_{bolinha}}\)
Para o líquido que possui densidade igual a 1, a densidade relativa será 1. Indicando densidades iguais, o comportamento da bolinha será ficar suspensa no líquido. Essa situação é observada na proveta 2.
Para a proveta que contém o líquido com densidade 1,2, a densidade relativa será maior do que 1, indicando líquido mais denso que a bola. Logo, a bolinha irá flutuar, pois possui densidade menor do que o líquido. Essa situação é observada na proveta 3.
Para a proveta que contém o líquido com densidade 0,8, a densidade relativa será menor do que 1. Então, a bolinha irá afundar, pois é mais densa do que o líquido. Essa situação é observada na proveta 1.
Artigos Relacionados

Últimas notícias
Outras matérias


















