Dissociação das bases

A dissociação das bases é um fenômeno físico que ocorre sempre que essas substâncias são adicionadas à água ou são submetidas ao processo de fusão (passagem do estado físico sólido para o líquido).
Durante a dissolução em água, ou na fusão, o fenômeno da dissociação das bases acontece porque esses compostos são iônicos (formados por ligação iônica) e, por isso, apresentam o ânion hidróxido interagindo com:
-
Um metal (Y) qualquer;
-
O cátion amônio (NH4+);
A forma de representar a dissociação de uma base é feita por meio de equações:
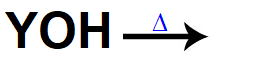
Equação representando uma base sendo dissolvida
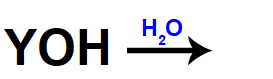
Equação representando uma base sendo dissolvida
No lado direito dessas equações, sempre aparecem o cátion (do elemento que pertence à base) e o ânion OH, seja no caso da dissolução, seja na fusão.
Um detalhe interessante é que a dissociação das bases é muito utilizada para indicar a força dessas substâncias, ou seja, a capacidade que elas possuem de liberar muitos ou poucos íons, característica que está diretamente relacionada com a capacidade de conduzir corrente elétrica. Dessa forma, temos:
-
Quanto mais a base liberar íons (base denominada forte), maior a corrente elétrica conduzida;
Não pare agora... Tem mais depois da publicidade ;) -
Quanto menos a base liberar íons (base denominada fraca), menor a corrente elétrica conduzida;
Para saber se a dissociação da base liberará muitos ou poucos íons, devemos adotar duas referências importantes:
1ª Conhecer a família do elemento químico:
-
Base forte: Metal alcalino ou alcalinoterroso;
Observação: O magnésio é um elemento químico que forma base fraca.
-
Base fraca: Qualquer outro metal.
Exemplo 1: Hidróxido de cálcio [Ca(OH)2] é uma base forte por apresentar o metal alcalinoterroso cálcio.
Exemplo 2: Hidróxido de alumínio [Al(OH)3] é uma base fraca por apresentar um metal que não pertence às famílias dos metais alcalinos e alcalinoterrosos.
2ª Conhecer o grau de dissociação (α) da base:
O grau de dissociação é um dado matemático que indica a relação entre a quantidade de partículas dissociadas da base, pelo seu número total, em porcentagem:
α = número de partículas dissociadas
Número de partículas total
Assim, se:
-
α ≥ 5% = Base forte
-
α < 5% = Base fraca
Exemplo 1: Hidróxido de sódio (NaOH), α = 80%, é uma base forte por apresentar alfa maior que 5%.
Exemplo 2: Hidróxido de titânio IV [Ti(OH)4], α = 0,6%, é uma base fraca por apresentar alfa menor que 5%.
Artigos Relacionados

Últimas notícias
Outras matérias


















