Fatores que alteram a pressão de vapor de um líquido

No texto “Pressão de Vapor” foi mostrado que esse termo refere-se à pressão exercida pelo vapor sobre o líquido num recipiente fechado em determinada temperatura e que é chamada de pressão máxima de vapor quando essa pressão atinge seu ponto máximo e estabiliza-se no equilíbrio dinâmico entre as duas fases (vapor e líquido).
Mas, a pressão de vapor depende de dois fatores: a natureza do líquido e a temperatura. Veja cada um:
- Natureza do líquido
Quando consideramos diversos líquidos diferentes, notamos que o mais volátil será o que tiver maior pressão de vapor. Por exemplo, digamos que há três recipientes abertos, sendo que no primeiro, temos água; no segundo, temos álcool (etanol); e no terceiro, temos éter (etoxietano), todos na mesma quantidade.

Depois de deixar um tempo em repouso, notaremos que o volume deles estará diferente: o volume da água será o maior e o do éter será o menor, o que significa que o éter evaporou mais, seguido do álcool e, por último, a água.
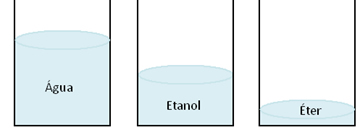
Portanto, o éter é o composto mais volátil dos três. Se os recipientes estivessem fechados, os sistemas entrariam em equilíbrio dinâmico e o que apresentaria maior pressão de vapor seria o éter, enquanto que a água teria a menor pressão de vapor.
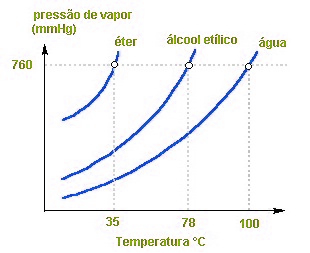
Isso acontece porque para que uma molécula passe para o estado de vapor, ela precisa ganhar energia suficiente para romper suas ligações intermoleculares. Portanto, quanto mais intensa for a força intermolecular, mais difícil será para passar para o estado de vapor, menos volátil será o líquido e, consequentemente, sua pressão de vapor será menor.
As interações intermoleculares realizadas entre as moléculas de água (ligações de hidrogênio) são mais fortes, seguidas da molécula de etanol e do etoxietano.
Além do tipo de interação intermolecular, a massa molar também influencia. Note abaixo que a massa molar da água é menor que a do álcool, que, por sua vez, é menor que a do éter. Assim, quanto maior a massa molar, maior será a energia que as moléculas precisarão para romper a inércia e as ligações intermoleculares e, assim, passarem para o vapor; ou seja, menos volátil será e com menor pressão de vapor.
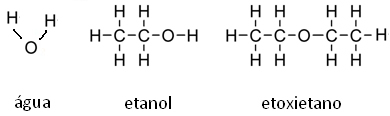
- Temperatura:
Quanto maior a temperatura, mais energia terão as moléculas e mais fácil será para elas passarem para o estado de vapor, o que acarretará numa maior pressão de vapor.
Por exemplo, a 20ºC, a pressão de vapor da água é de 17,535 mmHg. Em 50ºC, essa pressão passa para 92,51mmHg e, em 100 ºC, atinge a pressão de 760mmHg. Note essa relação entre a temperatura e a pressão de vapor no esquema e no gráfico a seguir:
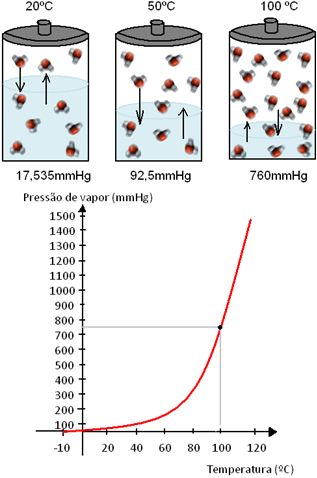
Isso acontece com todos os líquidos. Portanto, quando um mesmo líquido é submetido a diferentes temperaturas, ele apresentará pressões de vapor diferentes.
É por isso que quanto mais quente o dia está, mais rápido será para a roupa que colocamos no varal secar, ou seja, a água evaporará mais depressa, sua pressão de vapor aumentará.
Artigos Relacionados

Últimas notícias
Outras matérias


















