Ligação metálica

A ligação metálica é um tipo de ligação química que existe entre átomos de elementos metálicos. Graças a sua compreensão, entendemos o porquê das propriedades básicas dos metais, como: alto ponto de fusão, condutividade térmica e elétrica, além da maleabilidade e ductilidade. A ligação metálica é não direcional e muito forte por conta da grande compactação existente da estrutura sólida dos metais.
A ligação metálica foi primeiro descrita, por Paul Drude, por meio da teoria do mar de elétrons. Embora tal teoria seja muito importante e simplifique diversas discussões acerca do comportamento dos metais, foi com a introdução da mecânica quântica, com base na teoria do orbital molecular, que a ligação metálica foi melhor descrita.
Leia mais: Ligação covalente — formada pelo compartilhamento de elétrons entre dois átomos não metálicos
Resumo sobre ligação metálica
- A ligação metálica é um tipo de ligação química que ocorre entre átomos de elementos metálicos.
- É compreendida pela ideia de que os sólidos metálicos adotam estruturas altamente compactadas.
- Não é direcional, além de ser muito forte, graças à proximidade dos átomos e à alta atratividade entre eles, justificando os altos pontos de fusão.
- Explica por que os metais são maleáveis, dúcteis, além de bons condutores térmicos e elétricos.
- O modelo do mar de elétrons (ou dos elétrons livres) foi a primeira tentativa de descrever a ligação entre os metais.
- A mecânica quântica, por meio da teoria do orbital molecular, permitiu uma melhor interpretação da ligação metálica, diminuindo as lacunas deixadas pelo modelo do mar de elétrons.
- A compreensão da ligação metálica nos auxilia a entender a formação e as propriedades dos compostos metálicos, como as ligações metálicas.
Videoaula sobre ligação metálica
O que é ligação metálica?
A ligação metálica é uma modalidade de ligação química que ocorre entre espécies metálicas, dando origem às substâncias metálicas conhecidas .
Princípios da ligação metálica
Quando falamos de ligações químicas, pensamos sempre nas ligações iônica e covalente. Em tese, poderíamos imaginar que os metais acabariam se ligando com caráter covalente, contudo, essa modalidade de ligação versa sobre átomos no estado gasoso, o que é diferente para os metais, já que quase todos (à exceção do mercúrio) se apresentam como sólidos em condições ambiente.
Para entendermos a ligação metálica, devemos entender que os sólidos metálicos adotam uma estrutura altamente compactada, imaginando os átomos metálicos como esferas idênticas, colocadas uma ao lado da outra com o menor espaço possível entre elas.
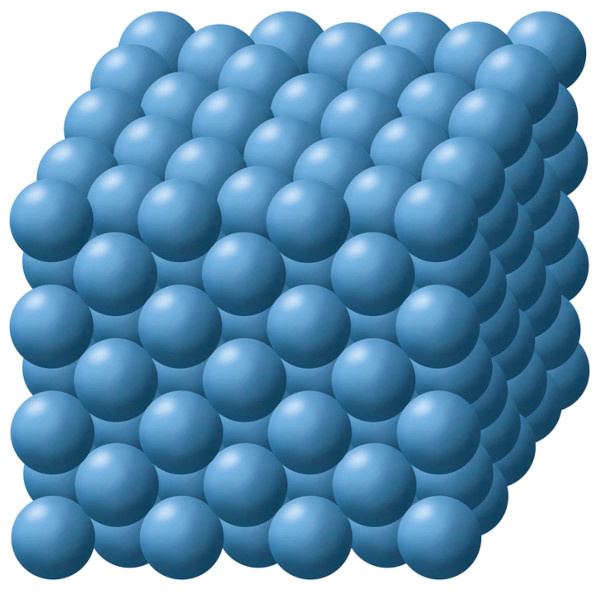
Repare que as esferas de camadas superiores ocupam as vacâncias deixadas por camadas inferiores a fim de garantir maior compactação. Essa estrutura altamente compactada é o ponto de partida para entendermos a forma como os átomos metálicos exercerão atração entre si.
Além disso, compostos metálicos diferentes podem apresentar formas de compactação diferentes, sendo sempre levado em conta a que lhe garantirá maior estabilidade mediante sua configuração eletrônica.
Características da ligação metálica
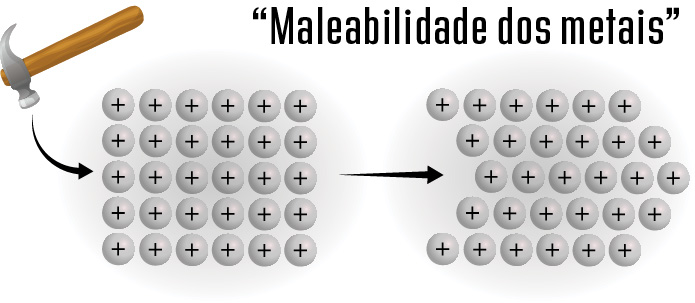
A compactação dos átomos metálicos garante características específicas da ligação metálica. A característica mais aparente é a grande força de atração entre os átomos metálicos. A compactação existente também explica a maior densidade das substâncias metálicas, uma vez que os átomos tendem a ocupar o maior espaço possível.
A ligação metálica, assim como a ligação iônica, não é direcional, ou seja, as forças de atração entre os átomos ocorrem em todas as direções e da mesma forma. A forma de ligação entre os átomos metálicos também pode explicar propriedades básicas, como a maleabilidade deles.
Quando estressado (mediante um impacto mecânico, por exemplo), as camadas de átomos metálicos podem se movimentar, fazendo com que os átomos cheguem a novas posições, sem que haja ruptura da ligação metálica.
Tipos de ligação metálica
Existem dois modelos para a explicação da ligação metálica. Um, obsoleto, mas muito importante, foi desenvolvido por Paul Drude, no ano de 1900. O modelo em questão é conhecido como mar de elétrons ou nuvem de elétrons.
O modelo de Drude, embora muito importante e muito útil para explicar aspectos básicos dos compostos metálicos, acaba falhando pelas limitações da mecânica clássica. Com o desenvolvimento da mecânica quântica, a ligação metálica foi mais bem descrita pela Teoria do Orbital Molecular (TOM), dando origem à noção de bandas de condução.
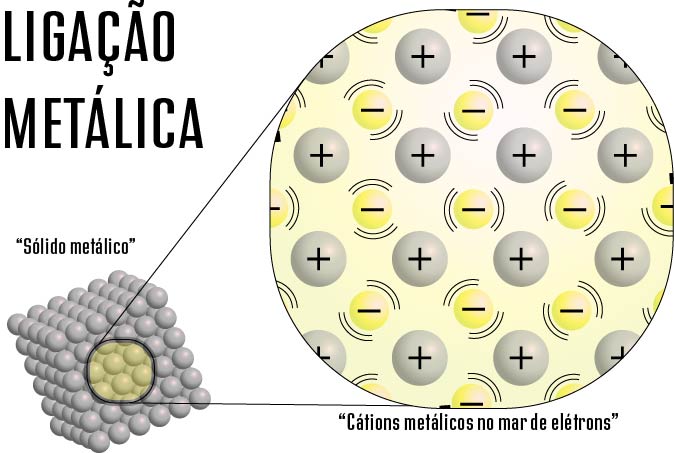
No modelo mar de elétrons, Drude se baseou na Teoria Cinética dos Gases, que descreve as moléculas de gases como esferas sólidas, rígidas e idênticas que se movimentam em linhas retas até colidirem entre si de forma elástica. Assim, Drude afirmou que, quando os átomos metálicos se uniam para formar ligações, os elétrons de valência (fracamente ligados, já que os metais têm baixa energia de ionização) sairiam da estrutura atômica e, assim, passariam a se movimentar livremente entre os (agora) cátions metálicos.
Os cátions se manteriam relativamente fixos, formando um arranjo tridimensional com elétrons livres se movendo por todo o volume do metal, com velocidade média igual a zero, como um gás (daí a ideia de “nuvem” ou “gás” de elétrons).
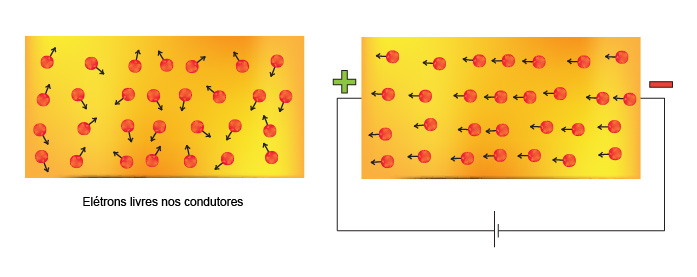
O modelo de Drude, apesar de obsoleto em diversos aspectos, apresenta explicações muito coerentes para a condutividade elétrica e térmica dos metais. No caso da condutividade elétrica, ao se estabelecer um campo elétrico, os elétrons, antes com movimentação aleatória, adquirem uma pequena velocidade na direção do campo elétrico.
A quantidade de carga seria equivalente ao número de elétrons que atravessa uma área específica em um tempo específico. O modelo mar de elétrons, entretanto, não consegue fazer distinção entre condutores, isolantes e semicondutores.
No que diz respeito à condutividade térmica, Drude se baseia na avaliação empírica de que metais conduzem calor melhor que isolantes. Com isso, ele concluiu que a condutividade térmica dos íons (presentes tanto nos metais quanto nos isolantes) seria menos importante que a condutividade térmica realizada pelos elétrons livres (presentes apenas nos metais).
Segundo o autor, quando se aplica um ponto de calor em uma barra metálica, os elétrons de regiões com maior temperatura colidem com mais energia cinética. Tais elétrons, ao se deslocarem para uma região de menor temperatura, apresentarão maior energia do que os elétrons lá existentes, estabelecendo-se um fluxo de energia térmica ao longo da barra.
De modo geral, o modelo mar de elétrons falha na aproximação do teórico com o experimental, já que os resultados obtidos por Drude se afastavam significativamente dos observados experimentalmente.
É também um modelo que desconsidera as interações elétron-elétron, sendo mais possível de ser aplicado em metais de baixa massa atômica, não sendo muito coerente para a explicação de metais que tenham elétrons no subnível d. Mesmo assim, é satisfatório na explicação de propriedades dos metais; da dependência da temperatura em relação à capacidade térmica; e da relação entre condutividade elétrica e térmica.
Quando trazemos a explicação da ligação metálica para o campo da mecânica quântica, as falhas obtidas pelo modelo de Drude são atenuadas, fazendo com que a teoria se aproxime mais dos valores obtidos experimentalmente.
Segundo a Teoria do Orbital Molecular, quando dois orbitais atômicos (regiões de probabilidade de existência de elétrons) de diferentes átomos se ligam, formam dois orbitais moleculares, um de menor energia (chamado de ligante) e outro de maior energia (chamado de antiligante), caracterizando a ligação entre eles.
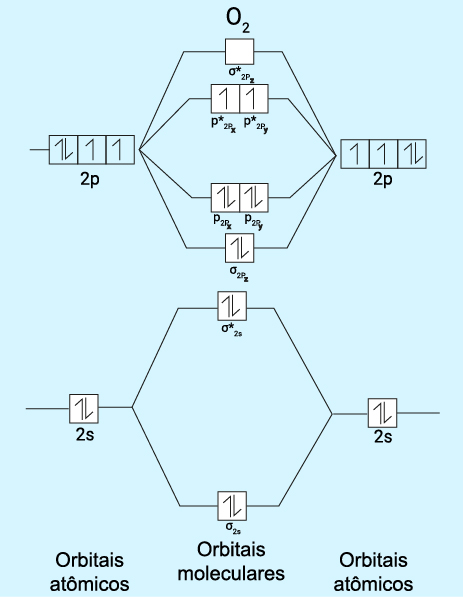
Só que, em um sólido metálico, devemos imaginar que há uma quantidade muito grande (na faixa de mols) de átomos metálicos. Sendo uma substância simples (mesmo elemento químico), entendemos que os orbitais atômicos têm praticamente a mesma energia.
A combinação desses diversos orbitais atômicos produz diversos orbitais moleculares, os quais não conseguem mais ser distinguidos entre si em termos de energia, originando um único e extenso orbital, que alocará todos os elétrons do metal, chamado de banda.
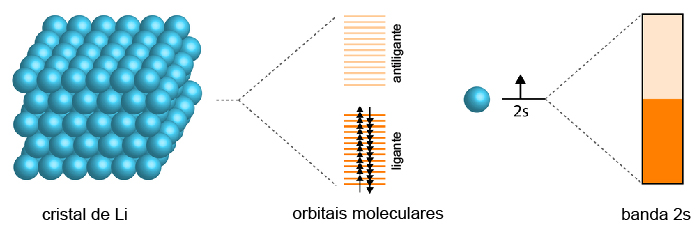
Da mesma forma que dois orbitais atômicos dão origem a dois orbitais moleculares, sendo um ligante e um antiligante, a combinação dos diversos orbitais atômicos originará duas bandas de menor e maior energia. A banda de menor energia, a qual aloca os elétrons, é chamada de banda de valência (é a última banda a receber elétrons). Já a banda de maior energia, vazia, é chamada de banda condutora.
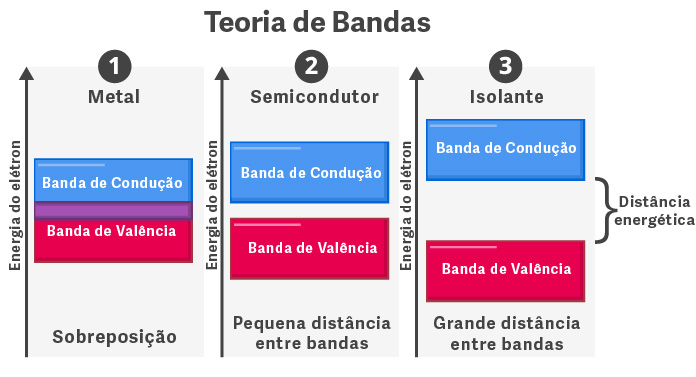
Nos metais, as bandas de valência e condutora se sobrepõem, formando uma única banda parcialmente preenchida de elétrons. Esse espaço permite a mobilidade eletrônica, justificando, assim, a condutividade elétrica em qualquer temperatura para os metais. No caso dos isolantes e semicondutores, a banda de valência está totalmente preenchida.
A diferença, entretanto, é que, nos isolantes, a distância energética entre a banda com e sem elétrons é muito grande, não permitindo a passagem de elétrons. Nos semicondutores essa distância energética é menor, possibilitando a passagem de elétrons a partir de certa temperatura.
A TOM também ajuda a explicar diferenças existentes entre metais. Ao formar orbitais moleculares, os elétrons usados para a ligação podem estar dispostos em orbitais moleculares de maior ou menor energia. Quando elétrons estão em orbitais moleculares de maior energia (os antiligantes), as ligações são mais fracas. Isso explica por que metais alcalinos e metais dos grupos 9 e 10 da Tabela Periódica têm baixo ponto de fusão.
O mercúrio, como se sabe, é líquido, consequência direta da disposição dos elétrons nos orbitais moleculares. Contudo, o melhor entendimento da TOM vem com estudos mais aprofundados da mecânica quântica e, por isso, muitas vezes, o modelo de Drude acaba sendo utilizado para explicar conceitos básicos dos metais.
Importância da ligações metálica
A compreensão de um modelo para explicar a ligação entre átomos metálicos é essencial para entendermos esses compostos. Atente-se ao fato de que boa parte dos elementos da Tabela Periódica são metais.
Graças aos modelos de ligação metálica, hoje é possível compreender, em nível atômico, como se dá a condução elétrica, a condução térmica, entre outras propriedades, tais como a ductilidade, a maleabilidade, a formação do brilho metálico, as diferenças de densidade, o ponto de fusão e os diferentes níveis de dureza dos metais.
Outro aspecto importante é que, por meio da ideia da ligação metálica, conseguimos compreender como se formam as ligas metálicas — compostos formados por dois ou mais metais. Para se formar ligas, dois ou mais metais devem ser fundidos e, depois, solidificados novamente.
Uma liga metálica pode ser homogênea — os átomos dos elementos se distribuem uniformemente (como no bronze e latão) — ou heterogênea — formada por misturas com fases cristalinas de composições diferentes (como no caso das amálgamas de mercúrio-prata, que chegaram a ser usadas por dentistas). As ligas, como são misturas, não apresentam ponto de fusão específico, como os metais puros, mas sim intervalos de solidificação e fusão.
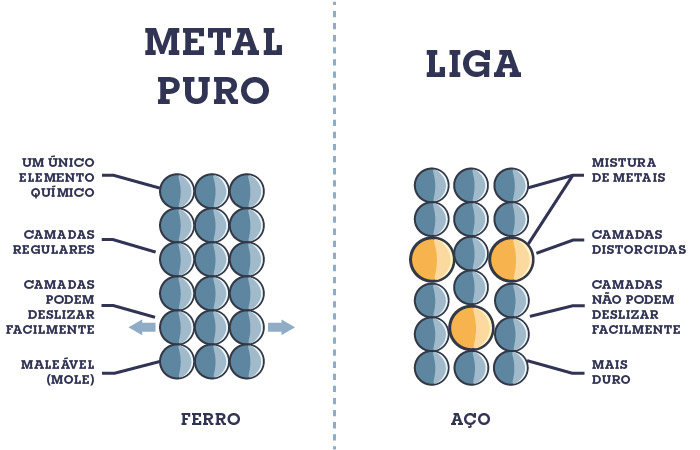
Outra classificação possível para ligas metálicas é a que divide as ligas em substitucional e intersticial. Nas ligas substitucionais, os átomos de um metal substituem os do outro ao longo da estrutura. A condição para tal é a proximidade de raio atômico (não pode ter diferença maior que 15%). Um exemplo é a liga de cobre e zinco, usada em moedas.
Os átomos de diferentes tamanhos na liga substitucional distorcem a estrutura metálica, dificultando a condutividade elétrica em relação ao metal puro, mas aumentando sua dureza e força, já que piora a movimentação das camadas metálicas entre si.
Já nas ligas intersticiais, os demais átomos são alocados nos buracos (interstícios) existentes na estrutura metálica. Lembre-se de que, na estrutura altamente compacta dos metais, ainda existem espaços pequenos entre os átomos. Por isso, para que seja possível, o raio do átomo a ser colocado no interstício deve ser de até 60% do átomo hospedeiro. As ligas intersticiais têm menor condutividade elétrica que o átomo metálico puro, mas a presença de átomos no insterstício dificulta a movimentação das camadas metálicas, aumentando assim a dureza e a resistência das ligas em relação ao metal hospedeiro puro.
Exercícios sobre ligas metálicas
Questão 1. (Uece/2019) A nível de ilustração, os núcleos dos átomos são considerados ilhas mergulhadas em um mar de elétrons.
Essa comparação nos leva a concluir que se trata de uma ligação química
A) metálica.
B) iônica.
C) covalente polar.
D) covalente apolar.
Resposta: Letra A
A descrição do enunciado faz referência ao modelo de Paul Drude do mar de elétrons, em que os metais perdem seus elétrons de valência, os quais ficam livres e estabelecem a ligação. Portanto, trata-se da ligação metálica.
Questão 2. (Uece/2018) Um estudante de química encontrou, na bancada do laboratório, um frasco sem rótulo contendo uma substância desconhecida inodora e incolor. Submeteu a amostra a alguns testes e descobriu que ela apresentava altas temperaturas de fusão e de ebulição, boa condutividade elétrica, grande maleabilidade e boa condutividade térmica. A partir das informações coletadas, ele pode concluir acertadamente que o tipo de ligação predominante na citada substância era
A) covalente polar.
B) metálica.
C) covalente apolar.
D) iônica.
Resposta: Letra B
As características descritas — como altas temperaturas de fusão e ebulição, condutividade elétrica e térmica, além de boa maleabilidade — são referentes às substâncias metálicas, as quais realizam ligações metálicas.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
PFENNIG, B. W. Principles of Inorganic Chemistry. 1. ed. Nova Jérsia: John Wiley & Sons, Inc., 2015.
DUARTE, H. A. Ligações Químicas: Ligação Iônica, Covalente e Metálica. Química Nova Na Escola. n. 4. mai. 2001.
MERCIER, J. P.; ZAMBELLI, G.; KURZ, W. Atoms, molecules and the chemical bond. In: Introduction to Materials Science. Cap. 2. P. 17-49. Paris: Elsevier, 2002.
MERCIER, J. P.; ZAMBELLI, G.; KURZ, W. Structure of materials. In: Introduction to Materials Science. Cap. 4. P. 75-88. Paris: Elsevier, 2002.
CLARK, J. Mettalic Structures. out. 2012. Disponível em: https://www.chemguide.co.uk/atoms/structures/metals.html.
EAMES, E. V. Metallic bonding. Chemiatria. jun. 2014. Disponível em: https://www.chemguide.co.uk/atoms/structures/metals.html.
Artigos Relacionados

Últimas notícias
Outras matérias


















