Nitrogênio (N)

O nitrogênio, símbolo N, número atômico 7, é um ametal pertencente ao grupo 15 da Tabela Periódica. É comumente encontrado na forma do gás diatômico N2, principal constituinte da atmosfera terrestre, e conhecido por sua baixa reatividade química. Por conta de sua grande participação na atmosfera, a destilação fracionada do ar liquefeito é a principal forma de obtenção do gás nitrogênio em sua forma pura.
Importantíssimo para a vida humana, o nitrogênio está presente nas bases nucleicas e nas proteínas. É fundamental para as plantas, por isso é um macronutriente muito presente em fertilizantes. O ciclo do nitrogênio é importante para a síntese de biomoléculas nos seres vivos. Credita-se a descoberta do nitrogênio a Daniel Rutherford, em 1772.
Veja também: Cálcio — outro elemento essencial à vida humana
Resumo sobre nitrogênio
-
O nitrogênio é um ametal pertencente ao grupo 15 da Tabela Periódica.
-
Apresenta-se principalmente como gás nitrogênio, N2.
-
O gás nitrogênio é conhecido por sua inércia química.
-
Cerca de 78% da atmosfera terrestre é composta por gás nitrogênio.
-
É um elemento essencial para a vida de praticamente todos os seres vivos do planeta.
-
O ciclo do nitrogênio é um importante processo para a inserção desse elemento nos organismos.
-
O nitrogênio pode ser aplicado principalmente na produção de fertilizantes.
-
Sua descoberta é creditada ao químico Daniel Rutherford, em 1772.
Propriedades do nitrogênio
-
Símbolo: N.
-
Número atômico: 7.
-
Massa atômica: 14,007 u.m.a.
-
Eletronegatividade: 3,04.
-
Ponto de fusão: -210 °C.
-
Ponto de ebulição: -195,8 °C.
-
Densidade (g.L-1): 1,2506; 0,808 (líquido, -195,8 °C); 1,026 (sólido, -252 °C).
-
Configuração eletrônica: 1s2 2s2 2p3.
-
Série química: ametais, elementos representativos, grupo 15, pinictogênios.
Características do nitrogênio

O nitrogênio, símbolo N, apresenta-se comumente como um gás diatômico (N2), incolor, inodoro e inerte. Sua inércia química, aliás, fez com que Antoine Lavoisier o chamasse de “azoto”, termo que significa “sem vida”.
Como um líquido, também é incolor e inodoro, com aparência similar à água. Existem, ainda, duas formas alotrópicas do nitrogênio quando este se encontra na forma sólida, a alfa (α) e a beta (β), havendo interconversão entre ambas na temperatura de -237 °C.
Apesar de pouco reativo, em temperatura ambiente, o N2 pode se combinar ao lítio lentamente e, quando aquecido, além de se combinar com o metal alcalino, também reage com metais alcalinoterrosos, alumínio, silício, germânio e muitos elementos do bloco d.
Se misturado ao oxigênio e submetido a uma faísca, forma inicialmente o monóxido de nitrogênio (NO), que depois é convertido em dióxido de nitrogênio (NO2). Ainda é capaz de reagir com o gás hidrogênio, utilizando-se um catalisador, temperatura e pressão adequados, para a formação da amônia, em um processo conhecido como Haber-Bosch:
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Muitos elementos que são inertes ao gás nitrogênio, tais como Na, Hg e S, conseguem reagir com o nitrogênio atômico, formado quando o N2 passa por uma descarga elétrica.
Onde o nitrogênio pode ser encontrado?

A principal ocorrência do nitrogênio é em nossa atmosfera. Cerca de 78% dela é composta pelo gás N2, algo estimado em inimagináveis 4000 trilhões de toneladas.
Porém, tal abundância não se reflete na crosta terrestre: o teor é de cerca de 19 gramas para cada tonelada (19 ppm). A principal fonte mineral de nitrogênio é o salitre do Chile, de composição majoritária NaNO3, frequente nos desertos sul-americanos.
Obtenção do nitrogênio
O gás nitrogênio pode ser obtido industrialmente via destilação fracionada do ar atmosférico na forma líquida, tendo o produto final alguns traços de argônio e O2. O gás oxigênio pode ser removido pela adição de uma pequena quantidade de H2 e passagem por um catalisador de platina.
Há também o crescimento da utilização de membranas permeáveis para a separação de N2 e O2, pois é uma alternativa mais barata. Contudo, é uma técnica que produz um gás nitrogênio menos puro, com teores de O2 que variam de 0,5 a 5%, sendo também uma tecnologia mais aplicável para produção de menores volumes de gás.
Ciclo do nitrogênio
O nitrogênio é um dos elementos mais importantes para a vida, pois está na constituição das proteínas, ácidos nucleicos e outros constituintes celulares. Embora cerca de 78% da atmosfera terrestre possua gás nitrogênio, boa parte dos seres vivos não consegue aproveitar o nitrogênio, muito por conta da ligação N≡N, altamente energética e difícil de ser quebrada.
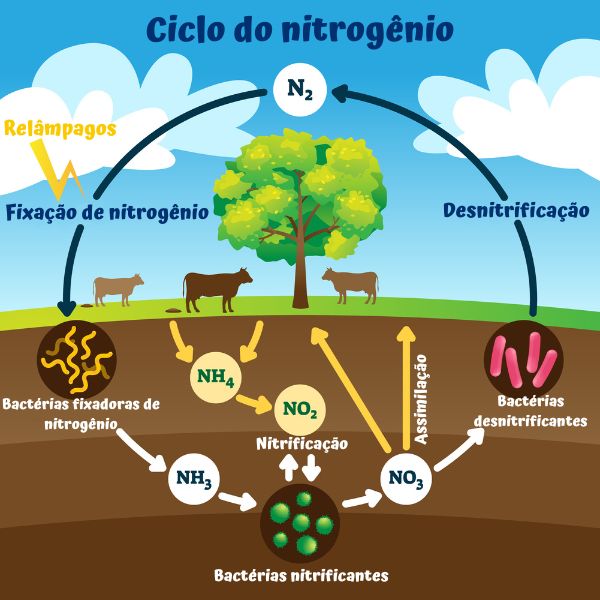
Por isso, é essencial a transformação e a reciclagem do nitrogênio, processo conhecido como ciclo do nitrogênio. Tal processo consiste em algumas etapas:
-
fixação do nitrogênio;
-
amonificação;
-
nitrificação;
-
desnitrificação.
O átomo de nitrogênio apresenta oito estados de oxidação possíveis: +5, +4, +3, +2, +1, 0, -1 e -3. A fixação do nitrogênio consiste em converter o N2 (cujo estado de oxidação do nitrogênio é zero) em qualquer uma das formas nitrogenadas. Assim, as formas de fixação do nitrogênio no solo são as seguintes:
-
Reações químicas naturais (fixação atmosférica): a ação de relâmpagos forma, por meio da água e do gás oxigênio, espécies químicas reativas capazes de atacarem o N2, formando assim o HNO3, que é então misturado à água da chuva.
-
Reações químicas industriais (fixação industrial): a principal forma de assimilação industrial de N2 é por meio do processo Haber-Bosch, o qual produz amônia, utilizada para produção de fertilizantes.
-
Processos biológicos: decomposição da matéria orgânica e também excreção de produtos nitrogenados por seres vivos, como ureia, ácido úrico e amônia.
-
Fixação biológica: é o processo mais importante de fixação e consiste na assimilação do N2 atmosférico por alguns seres vivos, como as bactérias Rhizobium, as quais vivem associadas às raízes de leguminosas (como feijão, soja, ervilha etc).
No processo de fixação biológica, o N2 é reduzido a amônio (NH4+) e então convertido em nitrato (NO3–), em um processo oxidativo feito por bactérias (como as Nitrosomonas) chamado de nitrificação:
NH4+ → NO2– → NO3–
Mesmo a forma NH4+ podendo ser utilizada para síntese de produtos nitrogenados, no solo ela é praticamente convertida por completo em nitrato, sendo esta a principal forma de assimilação de nitrogênio pelos vegetais.
O nitrato, então, é utilizado para a síntese de moléculas nitrogenadas. O nitrato não absorvido pelas plantas pode retornar à atmosfera como N2, em um processo de redução por algumas bactérias anaeróbias conhecido como desnitrificação.
Aplicações do nitrogênio
O gás nitrogênio é um dos produtos químicos mais importantes do mundo. Aliás, boa parte dele é convertido em amônia, produto essencial para a produção de fertilizantes. Segundo o U.S. Geological Survey, em 2018 foram produzidos mais de 140 milhões de toneladas de amônia no mundo todo, sendo os países asiáticos os maiores contribuidores para tal feito, em especial a China, cuja produção correspondeu a 29% do total. Rússia, Estados Unidos e Índia também são grandes produtores de amônia.
O processo industrial de fabricação de amônia é o processo Haber-Bosch, nome dado em alusão aos seus criadores, os alemães Fritz Haber e Carl Bosch. Enquanto Haber desenvolveu o processo em laboratório, Bosch foi responsável pelo desenvolvimento industrial da produção. Por causa disso, ambos foram laureados com o Prêmio Nobel de Química: Haber, em 1918, e Bosch, em 1931.
Na sua origem, a amônia era produzida para fins bélicos, no contexto da Primeira Guerra Mundial. Os alemães oxidavam a amônia produzida a ácido nítrico por meio do processo Ostwald (em homenagem a Wilhelm Ostwald, Prêmio Nobel de Química de 1909), o qual seria utilizado na confecção de explosivos. Atualmente, o ácido nítrico produzido pelo processo Ostwald é empregado para a síntese do nitrato de amônio, essencial na produção de fertilizantes.
A inércia química do gás nitrogênio também faz com que ele seja uma boa substância para criação de atmosferas inertes em laboratórios e indústrias. Já na sua forma líquida, o nitrogênio é um refrigerante de ampla utilização, como, por exemplo, na culinária, para congelamento e transporte de alimentos.
O nitrogênio também se destaca na indústria de explosivos, pois está presente no trinitrotolueno (TNT) e na nitroglicerina. Sais de nitrito e nitrato são utilizados como aditivos alimentares em carnes, já que auxiliam na conservação do alimento e ajudam na fixação da sua cor, uma vez que dificultam a oxidação do sangue presente.

Outros compostos de nitrogênio também possuem boas aplicações, como os cianetos, que podem ser usados na extração de metais nobres, como ouro, no processo conhecido como cianetação, e as azidas. Por exemplo, a azida de sódio é uma substância utilizada nos air bags, ao se decompor rapidamente em sódio metálico e gás nitrogênio, inflando a bolsa para proteção dos ocupantes do veículo.
Leia também: Potássio — outro elemento cuja principal utilização é na produção de fertilizantes
Relação do nitrogênio com o corpo humano
A vida do ser humano é intrinsicamente ligada ao nitrogênio, pois esse elemento é encontrado em toda a base nuclear do DNA. Durante a gravidez, o ácido fólico (vitamina B9), um outro composto nitrogenado, é essencial para o bom desenvolvimento fetal. A melanina, de fórmula C3H6N6, é o composto nitrogenado responsável pela pigmentação da pele e dos pelos.
As proteínas, biopolímeros formados por meio dos aminoácidos, são abundantes no corpo humano. Acredita-se que 16% do corpo humano seja constituído por proteínas, e elas estão presentes em todas as células dos organismos.
Precauções com o nitrogênio
Compostos de nitrogênio são conhecidos pelo seu potencial explosivo. No ano de 2020, mais especificamente no dia 4 de agosto, no porto da cidade de Beirute, capital do Líbano, um incêndio provocou a explosão de uma carga confiscada de nitrato de amônio, que seria utilizada para fabricação de fertilizantes.
![Vista do porto da cidade de Beirute, no Líbano, após a explosão causada por nitrato de amônio. [1]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2022/08/explosao-beirute-libano.jpg)
O cianeto é também um conhecido composto tóxico, que infelizmente foi utilizado em larga escala durante a Segunda Guerra Mundial nos campos de concentração nazistas para extermínio por asfixia e intoxicação de seus prisioneiros, em maior parte judeus. Os alemães o usaram na forma de ácido cianídrico, em um produto conhecido como Zyklon B.
História do nitrogênio
O nitrogênio tem sua descoberta creditada a Daniel Rutherford, descrito pelo cientista em sua tese de doutorado, em 1772, na Universidade de Edimburgo, Escócia.
Orientado por Joseph Black, Rutherford começou a estudar um gás que restava após reações de combustão, mesmo após a retirada de todo o conteúdo de gás carbônico. Inicialmente, Daniel Rutherford chamou o gás de “ar nocivo”, ao perceber que ele não era suficiente para manter a vida.
Apesar de Rutherford ser conhecido como o descobridor do elemento, deve-se citar sempre os trabalhos de outros cientistas famosos, como Carl W. Scheele, Henry Cavendish e Joseph Priestley, entre outros que também estudaram de forma extensa o gás nitrogênio.
Crédito de imagem
[1] diplomedia / Shutterstock
Artigos Relacionados

Últimas notícias
Outras matérias


















