Produto de Solubilidade

O produto de solubilidade é simbolizado por KPS ou KS e é uma constante de equilíbrio entre um sólido não dissolvido e seus íons. O estudo do produto de solubilidade (KPS) sempre envolve um soluto pouco solúvel em solução.
Consideremos o fosfato de cálcio (Ca3(PO4)2), um sal que possui pouca solubilidade em condições ambientes. Ao ser colocado em meio aquoso, ele dissocia-se e forma alguns íons, conforme a equação iônica a seguir mostra:
Ca3(PO4)2(s) → 3 Ca2+(aq) + 2 PO43-(aq)
No entanto, visto que sua solubilidade é pequena, alguns desses íons formados tendem a unir-se novamente, o que ocasiona a precipitação do sal:
3 Ca2+(aq) + 2 PO43-(aq) → Ca3(PO4)2(s)
Uma das possíveis origens dos cálculos renais (litíase nas vias urinárias, conhecida popularmente como “pedras nos rins”), inclusive, é que os íons desse sal (cálcio, Ca2+ e fosfato, PO43-) presentes no sangue unem-se muito facilmente no organismo humano, precipitando na forma de fosfato de cálcio nos rins.
Assim, forma-se o seguinte equilíbrio (a velocidade de dissociação iônica do sal (reação direta) é igual à velocidade da precipitação do sal (reação inversa)):
Ca3(PO4)2(s) ↔ 3 Ca2+(aq) + 2 PO43-(aq)
Conforme explicado no texto Constante de equilíbrio, essa constante em termos de concentração em quantidade de matéria (Kc) é expressa colocando-se, no numerador, a multiplicação das concentrações dos produtos da reação elevadas aos seus respectivos coeficientes na equação; e no denominador, coloca-se a multiplicação das concentrações dos reagentes também elevadas aos seus respectivos coeficientes. Assim, para o equilíbrio acima, temos:
Kc = [Ca2+]3. [PO43-]2
[Ca3(PO4)2]
No entanto, nesse mesmo texto é mostrado que as substâncias sólidas não entram na expressão de Kc porque a sua concentração é invariável. Visto que ela é uma constante, temos o seguinte:
Kc . [Ca3(PO4)2] = [Ca2+]3. [PO43-]2
Matematicamente, sempre que temos o produto entre duas constantes, há a formação de outra constante. Assim:
Kc . [Ca3(PO4)2] = KPS
Portanto, o nosso produto de solubilidade (KPS) é dado por:
KPS = [Ca2+]3. [PO43-]2
Podemos dizer que a expressão do produto de solubilidade (KPS) sempre é igual ao produto das concentrações em mol/L dos seus íons na solução saturada elevadas a uma potência que é igual ao seu coeficiente na equação de dissociação iônica do composto.
Por exemplo, considere a seguinte reação genérica:
AmBn(s) ↔ m An+(aq) + n Bm-(aq)
A expressão do produto de solubilidade é dada por:
KPS = [An+]m . [Bm-]n
Lembrando que quando falamos de produto iônico, referimo-nos à multiplicação [An+]m . [Bm-]n.
Importante: Não confunda a solubilidade (S) com o produto de solubilidade (KPS), pois a solubilidade é a quantidade de soluto dissolvida em determinado volume de solução. Já o produto de solubilidade (KPS) é uma constante de equilíbrio que está diretamente relacionada com a solubilidade.
A solubilidade (S) muitas vezes é chamada de constante de solubilidade (CS). Assim, o produto de solubilidade (KPS) pode nos ajudar a encontrar a constante de solubilidade do composto que queremos. Vejamos dois exemplos para entender como aplicar a expressão mostrada mais acima para descobrir o valor de KPS de um composto através da solubilidade e vice-versa:
Exemplo 1:
“Considerando que a solubilidade do Ca3(PO4)2, a 25ºC, vale 10-6 mol/L, qual será o valor do produto de solubilidade (KPS) para esse composto?”
Resolução:
* Primeiro escrevemos a equação que representa a dissociação iônica do sal:
Ca3(PO4)2(s) ↔ 3 Ca2+(aq) + 2 PO43-(aq)
* Vemos pelos coeficientes que a proporção estequiométrica é igual a 1 : 3 : 2. Assim, temos:

Parte de cálculo do produto de solubilidade
* Agora podemos jogar os valores das concentrações em mol/L dos íons na expressão de KPS:
KPS = [Ca2+]3. [PO43-]2
KPS = ( 3 . 10-6)3 . (2 . 10-6)2
KPS = 27 . 10-18 . 4 . 10-12
KPS = 108 . 10-30
KPS = 1,08 . 10-28
Exemplo 2:
“(UERJ) O hidróxido de magnésio, Mg(OH)2, é uma base fraca pouco solúvel em água, apresentando constante de produto de solubilidade, KPS, igual a 4 . 1012. Uma suspensão dessa base em água é conhecida comercialmente como “leite de magnésia”, sendo comumente usada no tratamento de acidez no estômago. Calcule, em mol/L, a solubilidade do Mg(OH)2, numa solução dessa base.”
Resolução:
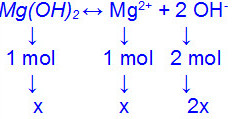
Parte de cálculo da constante de solubilidade
KPS = [Mg2+]. [OH-]2
4 . 1012 = x . (2x)2
x . (2x)2= 4 . 1012
x . 4x2= 4 . 1012
4x3 = 4 . 1012
x3 = 4 . 1012
4
x3 = 1012
x = 10-4 mol/L
Observe na expressão do produto de solubilidade (KPS) que essa grandeza é diretamente proporcional à concentração dos íons em solução. Isso quer dizer que o KPS nos indica se um composto será mais ou menos solúvel em água. Quanto mais íons em solução, mais solúvel é a substância e maior é o KPS e vice-versa.
Mas essa afirmativa é verdadeira para sais ou bases que são similares, ou seja, que, ao se dissociarem em solução aquosa, liberam para o meio a mesma quantidade de íons. Por exemplo, observe os dois compostos a seguir:
KPS (BaSO4) = 1,1 . 10-10
KPS (CaSO4 ) = 7,1 . 10-5
Observe que esses dois sais são de mesma natureza, ou seja, ambos liberam em solução aquosa um cátion e um ânion. Assim, podemos definir qual dos dois é mais solúvel observando apenas o valor do KPS. Veja que, observando somente a potência de 10, chegamos à conclusão de que o KPS do CaSO4 é maior, portanto, ele é mais solúvel que o BaSO4.
Agora quando os compostos liberam quantidades diferentes de íons no meio, é preciso calcular a solubilidade de cada um a partir do KPS, como foi feito no exemplo 2, e comparar os resultados.
Com esses cálculos, podemos fazer a seguinte relação entre o produto de solubilidade (KPS) e o produto iônico.
* Produto iônico = KPS → solução saturada;
* Produto iônico < KPS → solução insaturada;
* Produto iônico > KPS → solução saturada com corpo de fundo (ou solução supersaturada, o que é menos provável).
Se você tem dúvidas sobre esses tipos de soluções, leia o texto Solubilidade e Saturação.
Artigos Relacionados

Últimas notícias
Outras matérias


















