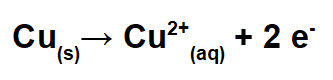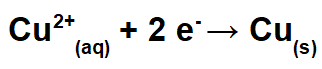Purificação do cobre

O processo de purificação do cobre é extremamente necessário na metalurgia, já que esse metal apresenta uma excelente capacidade de conduzir corrente elétrica e, por isso, é muito utilizado na produção de fios de eletricidade. Infelizmente, não existe na natureza cobre puro, o que possibilitaria a sua utilização imediata. Na realidade, o cobre é encontrado em uma série de diferentes minérios, como a calcopirita (CuFeS2), calcocita (Cu2S), bornita (Cu5FeS4), enargita (Cu3AsS4), além de ouro e prata.
.jpg)
A calcopirita é um minério que contém cobre.
O processo de purificação é necessário porque, quanto maior é a massa de impurezas no cobre, menor é a sua capacidade de condução de eletricidade. Com a purificação, seu nível de pureza pode chegar a mais que 99%, o que garante uma excelente condutividade.
Assim, para atingir esse percentual de pureza, dois processos de purificação do cobre podem ser realizados: a flotação, método físico que separa as impurezas que apresentam densidades superiores à do cobre, e uma eletrólise em meio aquoso, uma etapa química. Vamos entender melhor o processo de eletrólise.
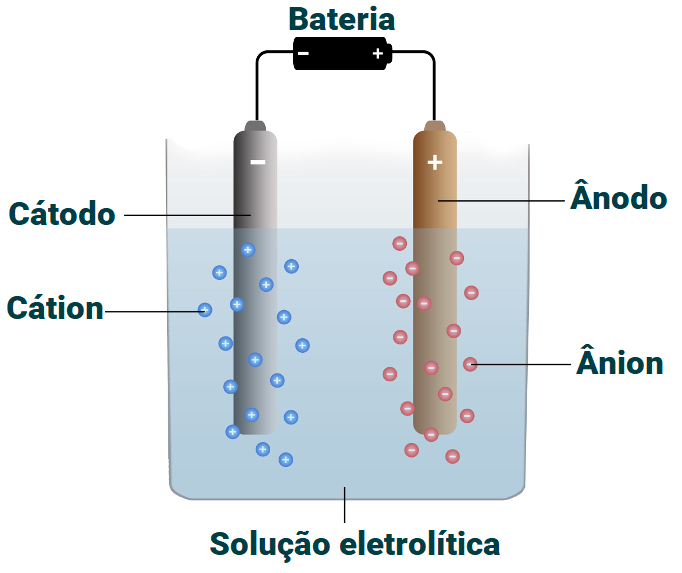
Representação de um sistema eletrolítico para purificação do cobre.
Na solução de um processo de purificação do cobre, utilizam-se água como solvente e sulfato de cobre como soluto. Ao se dissolver na água, o sulfato de cobre dissocia-se, liberando cátions cobre II e ânions sulfato [SO42-(aq)]
No polo positivo, ocorre a oxidação (perda de elétrons). Nesse polo, é colocado um eletrodo de cobre impuro, que, durante a eletrólise, oxida-se, perdendo elétrons e formando os cátions de cobre II [Cu+2(aq)].
No polo negativo, ocorre a redução (ganho de elétrons). Nesse polo, é colocado um eletrodo de cobre puro, que, durante a eletrólise, sofre a redução dos cátions [Cu+2(aq)] presentes na solução, formando cobre metálico [Cu(s)].
No cátodo, há formação de uma massa de cobre, dando a impressão de que o eletrodo está crescendo.
Características do cobre
O cobre é um elemento de natureza metálica, logo, apresenta as características básicas de um metal, a saber:
-
condutibilidade elétrica (um dos metais de maior condutividade);
-
condutibilidade térmica;
-
elevados pontos de fusão (em torno de 1083 ºC) e ebulição (em torno de 2562 ºC);
-
é mais denso que a água (apresenta uma densidade igual a 8,94 g/cm³);
-
elevada resistência mecânica;
-
boa maleabilidade (capacidade de ser moldado) e ductibilidade (capacidade de formar fios).
Artigos Relacionados

Últimas notícias
Outras matérias